7.7.5 氢键
7.7.5 氢键
NH3、H2O和HF与同族氢化物相比,沸点、熔点、汽化热等物理性质表现出显著的差异,说明这些物质的分子间除了存在一般分子间力外,还存在另一种作用力——氢键(hydrogen bond)。
1.氢键的形成当H原子与电负性很大、半径很小的原子X(X可以为F、O、N)以共价键结合生成X—H时,共用电子对偏向于X原子,使H原子变成几乎没有电子云的“裸”质子,呈现相当强的正电性;且半径很小(约30pm),势能极高,极易与另一个分子中含有孤对电子且电负性很大的原子相结合而生成氢键。氢键可表示为X—H…Y。
形成氢键的两个条件如下:
(1)有一个与电负性很大的原子X形成共价键的氢原子。
(2)有另一个电负性很大,且有孤对电子的原子Y。
在化合物中容易形成氢键的元素有F、O、N、S等,形成氢键的强弱与这些元素的电负性有关,元素的电负性愈大,形成的氢键也愈强。氢键强弱的次序如下:
F—H…F>O—H…O>O—H…N>N—H…N>O—H…Cl>O—H…S
氢键既有方向性又有饱和性。
氢键的键能一般为15~35kJ·mol-1,比化学键的键能小得多,与分子间作用力的大小比较相近。
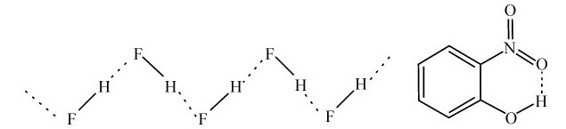
氢键可分为分子间氢键(intermolecular hydrogen bond)和分子内氢键(intramolecular hydrogen bond)。在同种分子间能形成氢键,不同分子间也能形成氢键。如(H2O)n、(HF)n和(HCOOH)n、(CH3COOH)n、对硝基苯酚等的氢键属同种分子间氢键。H2O和NH3,H2O和C2H5OH,苯甲酸和丙酮等之间的氢键,属于不同分子间氢键。分子间形成的氢键是直线型的,如图7.24所示,因为只有在直线方向两个带负电原子间的夹角最大,为180°,排斥力最小。同时X—H也只能与一个电负性很强的原子形成氢键,因为当它再与另一个原子接近时,要受到两个电负性大的原子的排斥,所以氢键与范德华力的主要区别是氢键具有方向性。
氢键不仅在分子间形成,也能在分子内形成,在分子内部形成的氢键称为分子内氢键,如邻硝基苯酚,如图7.24所示;或在苯酚邻位上有—CHO、—COOH、—OH等时,均可形成氢键。分子内的氢键常不能在一直线上。
2.氢键对化合物性质的影响因为分子间形成氢键,固体熔化或液体汽化时,不仅要破坏分子间的范德华力,还要提供额外的能量去破坏分子间的氢键。所以氢键的存在,影响到物质的某些性质。
(1)分子间氢键的生成使物质的熔、沸点比同系列氢化物的熔、沸点高。例如,HF、H2O、NH3的熔、沸点比其同族氢化物的熔、沸点要高。
(2)在极性溶剂中,氢键的生成使溶质的溶解度增大。例如,HF和NH3在水中的溶解度较大。
(3)存在分子间氢键的液体,一般黏度较大。例如,磷酸、甘油、浓硫酸等多羟基化合物,由于氢键的生成而为黏稠状液体。
(4)液体分子间若生成氢键,有可能发生缔合现象。分子缔合的结果会影响液体的密度。
H2O分子间也有缔合现象。降低温度,有利于水分子的缔合。温度降至0℃时,全部水分子结合成巨大的缔合物——冰。由于分子必须按照氢键轴排列,所以它的排列不是最紧密排列,因此冰的密度比水小。
氢键在生物大分子如蛋白质、核酸及糖类等中有重要的作用。蛋白质分子的α-螺旋结构就是靠羰基(C=O)上的氧和氨基(—NH)上的氢以氢键(C=O…H—N)彼此联合而成。DNA脱氧核糖核酸的双螺旋结构各圈之间也是靠氢键联合而增强其稳定性的。氢键在人类和动植物的生理、生化过程中也起着十分重要的作用。
