4.4.1 缓冲溶液的组成和机制
2025年09月17日
4.4.1 缓冲溶液的组成和机制
1.缓冲溶液的组成 缓冲溶液是分析化学、生物化学等实验中经常使用的重要试液之一,一般由弱酸(碱)及其共轭碱(酸)所组成,能控制氢离子浓度。常见的缓冲对主要有三种类型:
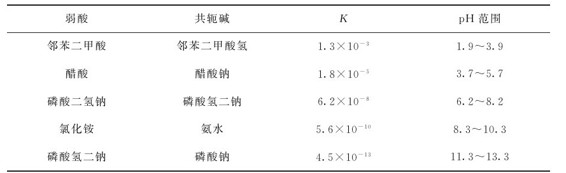
(1)弱酸及其对应的盐:例如:HAc—NaAc、H2CO3—NaHCO3、H2C8H4O4—KHC8H4O4(邻苯二甲酸—邻苯二甲酸氢钾)等。
(2)多元弱酸的酸式盐及其对应的次级盐:例如:NaHCO3—Na2CO3、NaH2PO4—Na2HPO4、NaH2C5HO7(柠檬酸二氢钠)—Na2HC6H5O7、KHC8H4O4—K2C8H4O4等。
(3)弱碱及其对应的盐:例如: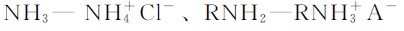 (伯胺及其盐)、Tris—TrisH+A-(三羟甲基烷及其盐)。
(伯胺及其盐)、Tris—TrisH+A-(三羟甲基烷及其盐)。
表4.3列出了一些缓冲溶液及其对应的K和pH。
表4.3 常见的某些缓冲溶液

2.缓冲原理 缓冲溶液为什么能够保持pH相对稳定,而不因其加入少量强酸或强碱pH就有较大的变化?假定缓冲溶液含有浓度相对较大的弱酸HA和它的共轭碱A-。在此溶液中加入少量强酸或强碱时,发生下列反应:
加酸时 A-+H→HA
加碱时 HA+OH-→A-+H2O
因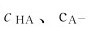 较大,加入少量强酸或强碱时溶液中的
较大,加入少量强酸或强碱时溶液中的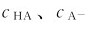 仅稍有变化,
仅稍有变化,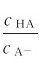 改变不大,
改变不大,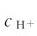 改变也很小,故pH基本保持不变。
改变也很小,故pH基本保持不变。
3.缓冲范围(Buffer range) 缓冲溶液的pH由pKa或pKb决定,其次还与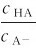 有关。当
有关。当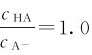 时,H=pKa。此时,缓冲溶液缓冲容量最大,而当
时,H=pKa。此时,缓冲溶液缓冲容量最大,而当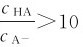 或<0.1时,溶液基本没有缓冲能力了,
或<0.1时,溶液基本没有缓冲能力了,
故 pH=pKa±1,pOH=pKb±1
在以上pH或pOH范围,缓冲作用有效,此范围即称为缓冲范围。在实际配制一定pH或pOH的缓冲溶液时,要选用pKa(或pKb)等于或接近于该pH值(或pOH值)的共轭酸碱对。
