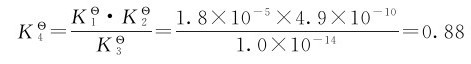3.4.1 平衡常数的计算
2025年09月17日
3.4.1 平衡常数的计算
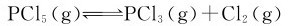


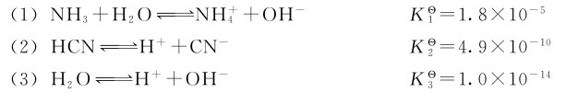
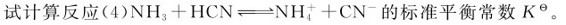
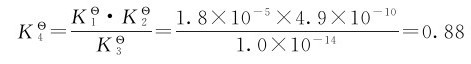
通常只要已知各反应物的起始浓度或起始分压,以及平衡时某一种物质的平衡浓度和平衡分压,即可计算出平衡常数。
例3.7 250℃时,PCl5按下式解离: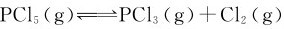 。将0.70mol的PCl5置于2.0L的密闭容器中,达平衡时有0.20mol分解。试计算该温度下的
。将0.70mol的PCl5置于2.0L的密闭容器中,达平衡时有0.20mol分解。试计算该温度下的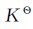 。
。
解:可根据所给的条件,先求出平衡时各气体的物质的量,再根据pV=nRT,求出相应的平衡分压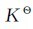 。
。
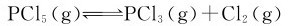
开始时物质的量/mol 0.70 0 0
变化的物质的量/mol 0.20 0.20 0.20
平衡时物质的量/mol 0.50 0.20 0.20
所以平衡时各物质的分压为

例3.8 反应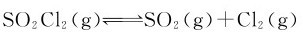 ,在373K时,将0.50mol的SO2Cl2放到2.0L的密闭容器里,平衡时有0.3mol的SO2Cl2分解。试计算在所给温度下反应的平
,在373K时,将0.50mol的SO2Cl2放到2.0L的密闭容器里,平衡时有0.3mol的SO2Cl2分解。试计算在所给温度下反应的平
衡常数Kc,Kp和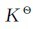 。
。

例3.9 已知下列各反应的标准平衡常数
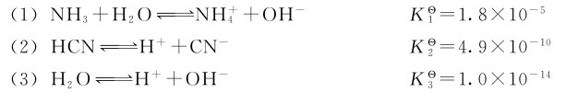
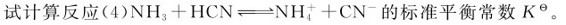
解:因为反应(4)=(1)+(2)-(3),由多重平衡规则可得: