10.1.6 过渡元素水合离子的颜色
2025年09月17日
10.1.6 过渡元素水合离子的颜色
过渡元素的离子在水溶液中常显出一定的颜色,主要是由于过渡元素离子的d轨道未填满电子,可与水分子形成配合物。根据配合物的晶体场理论,过渡金属离子的d轨道在水分子配位场的影响下会产生能级分裂。在受到外界能量激发时,可吸收和分裂能相同能量的可见光产生d-d跃迁,故使其显色。不同的离子,其d-d跃迁所需能量不同,吸收可见光的波长范围不同,显示颜色不同。第一过渡系元素低氧化数水合离子的颜色如表10.4所示。
表10.4 第一过渡系元素的低氧化数水合离子的颜色
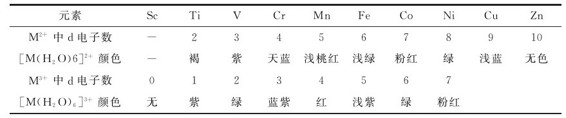
d0和d10构型的中心离子形成的配合物,在可见光照射下不发生d-d跃迁,如 均为无色。
均为无色。
同一中心离子与不同配体形成配合物时,由于晶体场分裂能不同,则d-d跃迁时所需能量也不同,因此显不同的颜色,如:SCN-的场强比H2O大,d轨道的能级分裂大,产生d-d跃迁所需能量就大,d电子吸收光的波长向短波方向移动,配合物的颜色移向长波方向。如:[Fe(H2O)6]3+显淡紫色,而[Fe(SCN)]2+为血红色。
