9.6.2 碳及其重要化合物
9.6.2 碳及其重要化合物
9.6.2.1 一氧化碳(carbon monoxide)
实验室是用浓H2SO4与甲酸或草酸作用得到CO:
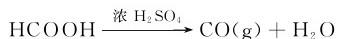
CO分子和N2分子各有10个价电子,是等电子体,所以CO同N2一样也具有三重键:1个σ键,2个π键。但是与N2分子不同的是,CO分子中的π键为配键,这对电子来自氧原子。其结构式为:

CO作为一种配体,能与一些有空轨道的金属原子或离子形成配合物。例如同 ⅥB、ⅦB和Ⅷ族的过渡金属形成羰基配合物:Fe(CO)5、Ni(CO)4和Cr(CO)6等。
CO之所以对人体有毒,是因为它能与血液中携带O2的血红蛋白(Hb)形成稳定的配合物COHb(CO与Hb的亲和力为O2与Hb的230~270倍),使血红蛋白丧失了输送氧气的能力,导致人体因缺氧而死亡。
CO还能使一些化合物中的金属离子还原。如:
CO+PdCl2+H2O=CO2+Pd↓+2HCl
CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3
这些反应都可以用于检测微量CO的存在。
9.6.2.2 二氧化碳(carbondioxide)
CO2的实验室制法是用盐酸和大理石(CaCO3)作用:
CaCO3(s)+2HCl=CaCl2+H2O+CO2↑
在CO2分子中,碳原子与氧原子生成4个键,2个σ键和2个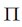 键。CO2中的碳氧键
键。CO2中的碳氧键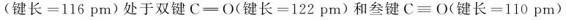 之间。但通常仍用
之间。但通常仍用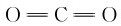 表示CO2分子。
表示CO2分子。

CO2分子没有极性,它很容易被液化,固体俗称干冰,是分子晶体,常压下于195K直接升华为气体,它是工业上广泛使用的制冷剂。
CO2不活泼,但在高温下能与活泼金属镁、钠等反应:
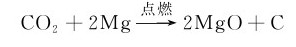
9.6.2.3 碳酸及其盐
CO2溶于水中形成碳酸(carbonic acid)。它是二元弱酸,在水中存在下列平衡:
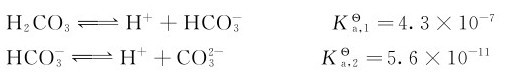
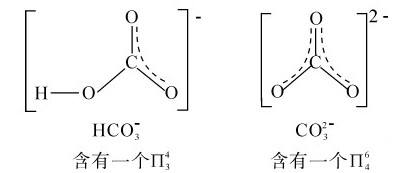
碳酸能生成两种盐:碳酸盐(carbonate)和碳酸氢盐(bicarbonate)。碳原子在这两种离子中均以sp2杂化轨道与三个氧原子的p轨道形成三个σ键,它的另一个p轨道与氧原子的p轨道形成离域 键,离子为平面三角形。图9.7所示为
键,离子为平面三角形。图9.7所示为 的结构。
的结构。
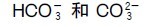 的结构
的结构
所有碳酸氢盐都溶于水,正盐中只有铵盐和碱金属的盐溶于水。易溶碳酸盐的溶解度大于酸式盐,这同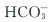 离子在它们的晶体中通过氢键结合成链有关。而难溶碳酸盐的溶解度小于酸式盐,如Ca(HCO3)2的溶解度大于CaCO3。
离子在它们的晶体中通过氢键结合成链有关。而难溶碳酸盐的溶解度小于酸式盐,如Ca(HCO3)2的溶解度大于CaCO3。
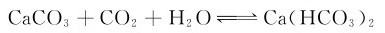
这个转化反应能说明自然界中钟乳石和石笋的形成原理。
碳酸盐均水解。在金属盐类(碱金属和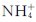 盐除外)溶液中加可溶性碳酸盐,产物可能是碳酸盐、碱式碳酸盐或氢氧化物。究竟是哪种产物,取决于反应物、生成物的性质和反应条件。如果金属离子不水解,将得到碳酸盐;如果金属离子的水解性极强,其氢氧化物的溶度积又小,如Al3+、Cr3+和Fe3+等,将得到氢氧化物:
盐除外)溶液中加可溶性碳酸盐,产物可能是碳酸盐、碱式碳酸盐或氢氧化物。究竟是哪种产物,取决于反应物、生成物的性质和反应条件。如果金属离子不水解,将得到碳酸盐;如果金属离子的水解性极强,其氢氧化物的溶度积又小,如Al3+、Cr3+和Fe3+等,将得到氢氧化物:
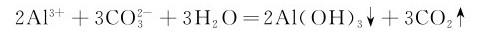
有些金属离子如Cu2+、Zn2+、Pb2+和Mg2+等,其氢氧化物和碳酸盐的溶解度相差不多,则可能得到碱式盐:
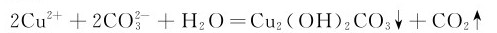
酸式碳酸盐的稳定性均比相应的正盐的稳定性差。碳酸盐受热分解的难易程度与阳离子的极化作用有关。阳离子对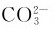 离子产生极化作用,使
离子产生极化作用,使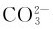 不稳定以致分解。阳离子的极化作用越大,碳酸盐就越不稳定。固体碳酸盐的热稳定性大小是:
不稳定以致分解。阳离子的极化作用越大,碳酸盐就越不稳定。固体碳酸盐的热稳定性大小是:
碱金属盐>碱土金属盐>过渡金属盐>铵盐
碳酸盐>碳酸氢盐>碳酸
例如:MgCO3<CaCO3<SrCO3<BaCO3
