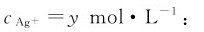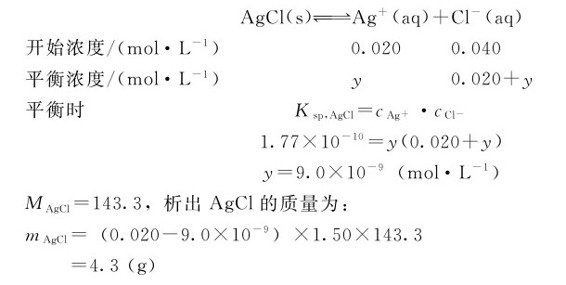4.5.2 溶度积规则
2025年09月17日
4.5.2 溶度积规则
对于难溶电解质的多相离子平衡来说:
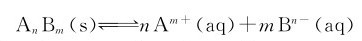
其反应商(又称难溶电解质的离子积)Q表达式可写作:
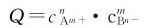
依据平衡移动原理,将Q与Ksp比较,可以得出:
Ksp表示难溶电解质沉淀溶解平衡时饱和溶液中离子浓度的乘积,在一定温度下为一常数;Q则表示任何情况下离子浓度的乘积,其值不定。
(1)Q>Ksp,平衡向左移动,沉淀从溶液中析出。
(2)Q=Ksp,溶液为饱和溶液,溶液中的离子与沉淀之间处于平衡状态。
(3)Q<Ksp,溶液为不饱和溶液,若原来系统中有沉淀,平衡向右移动,沉淀溶解。
这就是沉淀溶解平衡的反应商判据,称其为溶度积规则。常用此规则判断沉淀的生成与溶解能否发生。
例4.12 25℃下,在1.00L0.030mol·L-1的AgNO3溶液中加入0.50L0.060mol·L-1的CaCl2溶液,能否生成AgCl沉淀?如果有沉淀生成,生成AgCl的质量是多少?最后溶液中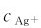 是多少?
是多少?
解:由附表5中查得Ksp,AgCl=1.77×10-10。将1.00LAgNO3溶液与0.50LCaCl2溶液混合后,认定混合溶液的总体积为1.50L。两种溶液混合后,Ca(NO3)2是可溶的,如有沉淀生成,只可能是AgCl沉淀。反应前,Ag+与Cl-浓度分别为:

为计算AgCl沉淀的质量和最后溶液中的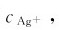 必须确定反应前后A+与Cl-浓度的变化量。因
必须确定反应前后A+与Cl-浓度的变化量。因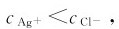 生成AgCl沉淀时,Cl-是过量的。设平衡时
生成AgCl沉淀时,Cl-是过量的。设平衡时