4.2.1 水的电离平衡
2025年09月17日
4.2.1 水的电离平衡
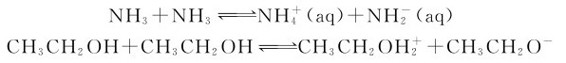
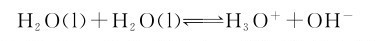
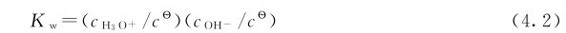

水在化学反应中是最重要的溶剂,其本身发生微弱的自偶电离。自偶电离指的是溶剂(不一定是水)电负性强的部分与电负性弱的部分相互作用,自发电离,产生液态极性共价分子合一组分的阴离子与液态极性共价分子失一组分阳离子的过程。只要是液态极性共价分子化合物,就可发生自偶电离;并且,极性越强,电离程度越大。
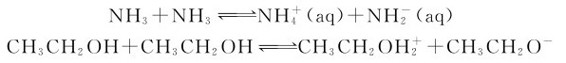
在纯水中,水分子、水合离子和氢氧根离子总是处于平衡状态。按照酸碱质子理论,水的自身解离平衡可表示为
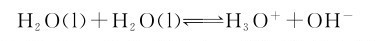
平衡时,水中的H3O+和OH-的浓度很小。根据水的电导率的测定,一定温度下,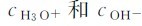 的乘积是恒定的。根据热力学中对溶质和溶剂标准状态的规定,水解离反应的标准平衡常数表达式为:
的乘积是恒定的。根据热力学中对溶质和溶剂标准状态的规定,水解离反应的标准平衡常数表达式为:
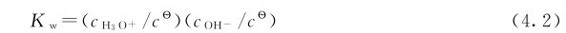
考虑到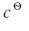 =1.0mol·L-1,书写平衡常数表达式时可不出现
=1.0mol·L-1,书写平衡常数表达式时可不出现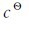 项。同时,平衡常数简写时可不带
项。同时,平衡常数简写时可不带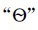 ,即
,即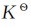 可简写为K。
可简写为K。
Kw被称为水的离子积常数或称离子积,下标W表示水。与其他平衡常数一样,Kw是温度的函数,不同温度下水的离子积不同。表4.1所示为不同温度下水的离子积常数Kw。
表4.1 不同温度下水的离子积常数Kw

