6.6.4 电负性
2025年09月17日
6.6.4 电负性
1932年,鲍林提出了电负性(electronegativity)的概念:原子在分子中吸引电子的能力,并指定F的电负性最大,为4.0。从相关分子的键能数据出发进行计算,并与F的电负性对比,得到其他元素的电负性数值,如表6.8所示。
表6.8 元素的电负性数值
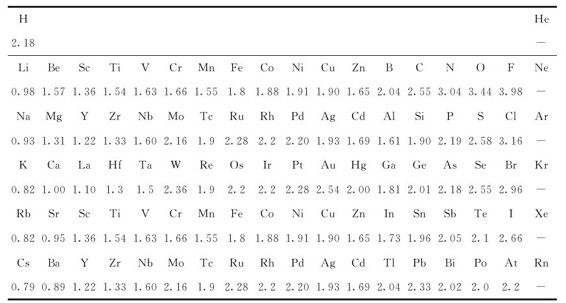
注:引自MacMillian, Chemical and Physical Data(1992).
电负性较全面地反映了元素金属性和非金属性的强弱,元素的电负性越大,表示原子在分子中吸引电子能力越强,即非金属性越强。在同一周期中,从左向右随着元素的非金属性逐渐增强而电负性递增。在同一主族中,从上向下电负性递减。在周期表中,氟是电负性最大的元素,而铯是电负性最小的元素,根据电负性的大小,可以衡量元素的金属性和非金属性。一般认为电负性在2.0以上的元素属于非金属元素,而电负性在2.0以下的属于金属元素。
