习题
习题
1.反应A+2B→C是基元反应,试计算cA=0.15mol·L-1、cB=0.03mol·L-1、k=0.005(mol·L-1)-2·s-1时的反应速率。
2.某温度下反应2NO(g)+O2(g)→2NO(g)的速率常数k=8.8×10-2(mol·L-1)-2·s-1,已知反应对O2来说是一级反应,求NO的反应级数及反应的速率方程。当反应物的浓度都为0.05mol·L-1时,计算反应的速率。
3.CO(CH2COOH)2在水溶液中分解成丙酮和二氧化碳。283K时分解反应速率常数为1.08×10-4mol·L-1·s-1,333K时为5.48×10-2mol·L-1·s-1。求303K时分解反应的速率常数。
4.已知反应CH3CHO(g)→CH4(g)+CO(g)的活化能Ea=188.3kJ·mol-1;如果以碘蒸气为催化剂,反应的活化能为Ea=138.1kJ·mol-1。计算温度为800K时,加入碘催化剂,反应速率增大为原来的多少倍?
5.某一化学反应B→C+D,cB=0.20mol·L-1时,B的反应速率是6.00mol·L-1·s-1。如果(1)对B是零级反应;(2)对B是一级反应;(3)对B是二级反应。问以上各种情况下的速率常数各是多少?单位是什么?
6.放射性同位素镅的氯化物AmCl3进行蜕变,经过2h分解了2.31%,求该放射性同位素的半衰期。
7.某一级反应在340K时完成20%需要的时间为3.2min,而在300K时同样完成20%需要的时间为12.61min,试求反应的活化能。
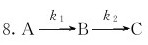 为一级连续反应,试证明:
为一级连续反应,试证明:
(1)若k1>k2,则C的生成速率决定于k2、k1。
(2)若k1<k2,则C的生成速率取决于k1。
9.反应2NO+2H2→N2+2H2O的反应机制为
(1)NO+NO→N2O2(快)
(2)N2O2+H2→N2O+H2O(慢)
(3)N2O+H2→N2+H2O(快)
试确定其总反应速率方程。
10.已知下列反应及在1123K时的标准平衡常数:
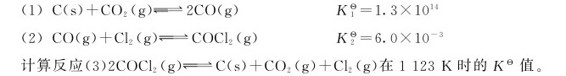
11.在250℃和100kPa下,PCl5发生分解反应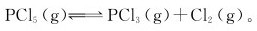 达到平衡时,测得混合气体的密度为2.695·L-1,求反应的
达到平衡时,测得混合气体的密度为2.695·L-1,求反应的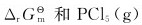 的解离度。
的解离度。
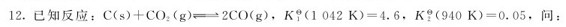
(1)上述反应为吸热反应还是放热反应?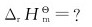
(2)940K的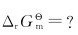
(3)该反应的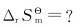
13.在高温下HgO(s)发生分解: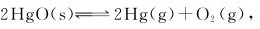 在723K时生成的两种气体的总压力为108kPa,在693K时分解的总压力是51.6kPa。
在723K时生成的两种气体的总压力为108kPa,在693K时分解的总压力是51.6kPa。
(1)计算在723K和693K时的平衡常数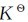 及HgO(g)和O2的分压力。
及HgO(g)和O2的分压力。
(2)如果将10.0g的HgO(s)放在1.0L的容器里,温度升高到723K,则有多少克的HgO(s)没有分解?
