10.3.2 锰的重要化合物
10.3.2 锰的重要化合物
锰的电势图如下:
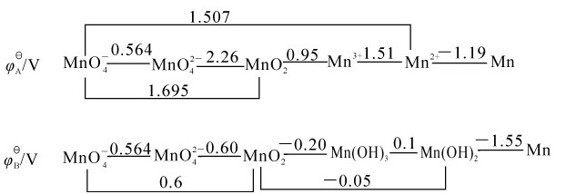
从锰的电极电势图可以看出,在酸性介质中,高价锰具有较强的氧化性,还原产物都是Mn2+;碱性介质中,相同氧化值的锰的氧化性降低,还原产物可以是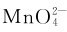 ,还原剂过量时也可以是。在酸性溶液中,
,还原剂过量时也可以是。在酸性溶液中,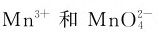 均易发生歧化反应:
均易发生歧化反应:
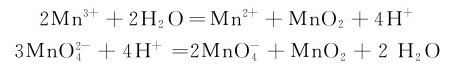
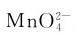 的歧化在碱性溶液中较弱。
的歧化在碱性溶液中较弱。
锰有多种可变的氧化值,以氧化数为+2,+4,+7的化合物最重要。
1.锰(Ⅱ)的化合物 锰(Ⅱ)的强酸盐均溶于水,只有少数弱酸盐如MnCO3、MnS等难溶于水。锰盐的水溶液及从水溶液中结晶出来的锰(Ⅱ)均呈粉红色,原因是Mn2+与水分子形成的配离子[Mn(H2O)6]2+呈粉红色。
在酸性溶液中,Mn2+比同周期的其他氧化值为+2的金属离子稳定,要将它氧化成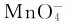 是很困难的,只有在高酸度的溶液中与强氧化剂反应,如过硫酸铵、铋酸钠或二氧化铅才能实现:
是很困难的,只有在高酸度的溶液中与强氧化剂反应,如过硫酸铵、铋酸钠或二氧化铅才能实现:
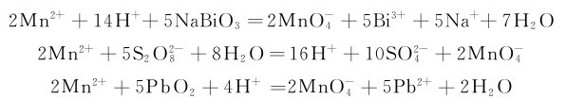
这些反应可鉴定溶液中微量的Mn2+。
在碱性介质中,MnⅡ易被氧化。向Mn2+盐溶液中加入强碱,可得到白色的Mn(OH)2沉淀,它在碱性介质中很不稳定,与空气接触即被氧化生成棕色的MnO(OH)2沉淀。
Mn2++2OH-=Mn(OH)2(白色)
2Mn(OH)2+O2=2MnO(OH)2(棕色)
室温下,MnSO4·5H2O是较稳定的,加热脱水为白色无水硫酸锰,加热到红热也不分解,所以硫酸锰是最稳定的锰(Ⅱ)盐。
2.锰(Ⅳ)的化合物 MnO2是锰(Ⅳ)的唯一化合物,为棕黑色粉末,是锰最稳定的氧化物,在酸性溶液中有强氧化性,例如:
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
在实验室中利用此反应制取少量氯气。
MnO2与碱共熔,可被空气中的氧所氧化,生成绿色的锰酸盐:
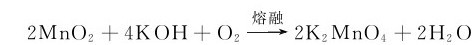
MnO2在工业上有很重要的用途,它是炼钢工业中制造锰合金的主要原料;用作干电池的去极化剂、火柴的助燃剂、玻璃的脱色剂、某些有机反应的催化剂,以及合成磁性记录材料铁氧体的原料等。
3.锰(Ⅵ)的化合物 锰酸盐为氧化值为的锰的化合物,仅以深绿色的锰酸根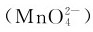 形式存在于强碱溶液中。在中性或酸性溶液中
形式存在于强碱溶液中。在中性或酸性溶液中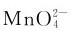 会立即歧化,生成
会立即歧化,生成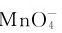 与MnO2,溶液由绿色变为紫红色。
与MnO2,溶液由绿色变为紫红色。
4.锰(Ⅶ)的化合物 锰(Ⅶ)的化合物中最重要的是高锰酸钾。往锰酸钾溶液中加酸,虽可制得高锰酸钾,但最高产率只有66.7%,最好的制备方法是用电解法或用氯气、次氯酸盐等为氧化剂,把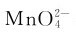 全部氧化为
全部氧化为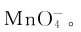
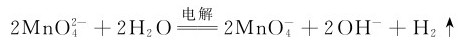
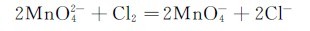
高锰酸钾俗称灰锰氧,是深紫色的晶体,它是一种较稳定的化合物,是一种强氧化剂,其水溶液呈紫红色。将固体KMnO4加热到473K以上,就分解放出氧气,是实验室制备氧气的一种简便方法。
2KMnO4=K2MnO4+MnO2+O2↑
高锰酸钾的溶液并不十分稳定,在酸性溶液中缓慢地分解析出MnO2:
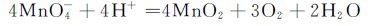
在中性或微碱性溶液中,这种分解的速度更慢。但是光对高锰酸盐的分解起催化作用,因此,KMnO4溶液必须保存于棕色瓶中。
KMnO4是最重要和常用的氧化剂之一,在酸性溶液中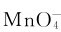 的氧化能力很强,它可以定量氧化
的氧化能力很强,它可以定量氧化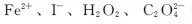 等。分析化学中
等。分析化学中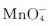 用于测定铁、过氧化氢和草酸盐的含量。
用于测定铁、过氧化氢和草酸盐的含量。
KMnO4氧化能力随介质的酸性减弱而减弱,其还原产物也因介质的酸碱性不同而变化,在酸性、中性(或微碱性)、强碱介质中的还原产物分别为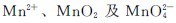 ,如:
,如:
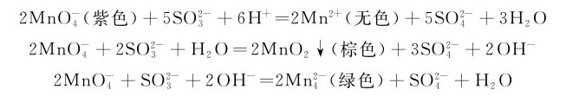
粉末状的KMnO4与90%H2SO4反应,生成绿色油状的高锰酸酐Mn2O7。它在273K以下稳定,在常温下会爆炸分解成MnO2、O2和O3。这种氧化物有强氧化性,遇有机物就发生燃烧。
