5.5.1 电解
1.电解定律 自发氧化还原反应所组成的电池的电动势等于两个电极电势差(Ecell=φ正-φ负)。若从外部施加相反方向的电压等于或大于自发电动势,就有可能使非自发反应发生电解反应。电解过程中,与电源正极相连的一端称为阳极(an-ode),与电源负极相连的一端称为阴极(cathode),如图5.7所示。阳极发生氧化反应,阴极发生还原反应。在讨论原电池的电极反应时,常用正极、负极表示两个电极电势的高低,电势高的是正极,电势低的是负极,在外电路电流由正极流向负极。外电源的负极和电解池的阴极相连,外电源的正极和电解池的阳极相连。
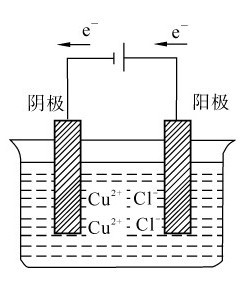
例如CuCl2溶液的电解,其电解反应为:
阴极:Cu2++2e-→Cu 还原反应
阳极:2Cl-→Cl2+2e- 氧化反应
电解反应:Cu2++2Cl-=Cu+Cl2
1834年,法拉第(M.Faraday)通过实验归纳出法拉第电解定律:在电解过程中,电极上析出物质的量与溶液中通过电解液的电量成正比,其数学表达式为:
Q=nF
式中,n为物质的量(mol),Q为通过的电量(Q=I·t,单位为库仑),F为法拉第常数96500(1mol电子所具有电荷的电量,单位为C·mol-1)。
在实际电解生成过程中,因副反应的发生,电解产物的产量总是低于理论产量。实际产量与理论产量之比称作电流效率,即:

2.分解电压 分解电压指使电解反应发生所需要的最小外加电压,也称实际分解电压。实际分解电压大于理论分解电压,其原因在于电解的实际情况中发生了电极极化作用,形成了过电势(超电势)。因为理论分解电压是在理想状态下得到的,实际电解过程不可能是理想的。例如,溶液中存在内阻,电解时必须消耗一定的电压(U=IR内),这部分电压损失将转化为热能;另外,电极过程的浓差极化及电化学极化导致电极放电超电势产生。
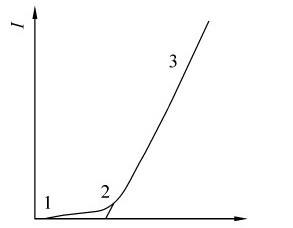
理论分解电压对实际分解电压的估算有重要参考价值,分解电压可以通过实验求得。如果以电压为横坐标,电流强度为纵坐标,可得到图5.8所示的曲线。例如,水的电解反应:
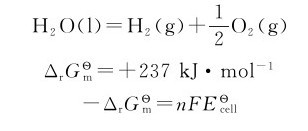
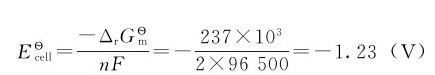
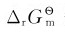 等于正值,
等于正值,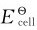 等于负值,即H2O不能自发分解成H2和O2。以上计算还说明,只要外加电压≥1.23V,理论上就能使水发生电解。电解H浓度为1mol·L-1的水溶液时,电解池两极所发生的反应为:
等于负值,即H2O不能自发分解成H2和O2。以上计算还说明,只要外加电压≥1.23V,理论上就能使水发生电解。电解H浓度为1mol·L-1的水溶液时,电解池两极所发生的反应为:
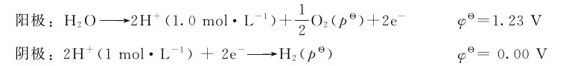
根据吉布斯自由能变化或电极电势计算所求得的非自发反应,发生电解所需的最低电压称为理论分解电压。按前面的计算,电解水的理论分解电压即为1.23V;但在实际工作时,由于电解电池的内部原因,外加电压必须高于1.23V才能输入电流使电解反应进行。按图5.9原理的装置可以测定实际所需的外加电压。
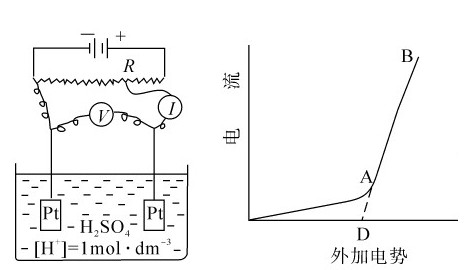
控制电阻(R),以调节输入电压。当电压(U)逐渐升高时,电流(I)在开始时增加极少;当电压升高到1.7V时,电流突然增大,同时可以看到电极上有许多气泡产生,在阳极产生氧气,在阴极产生氢气。这表示H2O的电解反应要在电压为1.7V时才能发生。使电解反应能顺利进行的最低电压D称为分解电压(图5.9)。分解电压与理论分解电压之间的电压差称为超电压。事实表明,由于电流的通过,两极的电极电势在通电前后必定发生了某些改变,这种现象叫做极化。极化是由电解质溶液内阻、浓差极化和电极极化所引起的。
国际上规定,无论是阴极超电势还是阳极超电势,均取正值,并用η表示。
阴极上的超电势:η阴=φ阴(理)-φ阴(实)
阳极上的超电势:η阳=φ阳(实)-φ阳(理)
阴极超电势与阳极超电势之和称为超电势,即E超=η阴+η阳
实际分解电压应该是理论分解电压、电解池的超电势和IR电势降等之和,即
E实=E理+E超+IR+E浓
通常E浓和IR数值较小,超电势的存在是使实际分解电压大于理论分解电压的主要原因。
