习题
习题
1.写出下列指定元素在各自化合物中的氧化数:
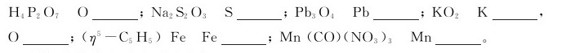
用氧化数法配平下列反应式。
(1)FeS2+O2→Fe2O3+SO2
(2)H2O2+KI+H2SO4→K2SO4+I2+H2O
(3)NH4NO2→N2+H2O
(4)P4+HNO3→H3PO4+NO↑
(5)KMnO4+H2C2O4→K2CO3+MnO2+H2O+CO2
3.用离子-电子法配平下列方程式。
(1)Cu+HNO3(浓)→Cu(NO3)2+NO2↑+H2O
(2)NaClO+NaCrO2+NaOH→NaCl+Na2CrO4+H2O
(3)H2O2+KMnO4+H2SO4→MnSO4+K2SO4+H2O
(4)I2+NaOH→NaIO3+NaI
(5)HCNS+KClO3→CO2+NO+SO2+KCl+H2O
4.写出下列各电对的电极反应。
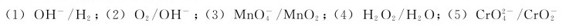
5.写出下列电池的电极反应和电池反应,并计算其电极电势。
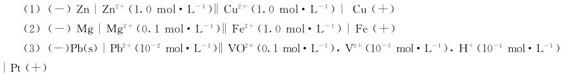
6.能否配制含有等浓度(mol·L-1)的下列各对离子的酸性水溶液?为什么?
(1)Sn2+和Hg2+;
(2)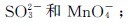
(3)Sn2+和Fe2+。
7.根据电极电势解释下列现象:
(1)金属铁能置换铜离子,而三氯化铁溶液又能溶解铜板。
(2)二氯化锡溶液贮存易失去还原性。
(3)硫酸亚铁溶液久放会变黄。
(4)锂的标准电极电势虽比钠低,但为什么锂与水的作用不如钠剧烈?
(5)重铬酸钾能氧化浓盐酸中的氯离子,而不能氧化浓氯化钠溶液中的氯离子。
8.计算298K时下列反应的标准吉布斯自由能变,并将其设计成原电池,写出电池符号和电极反应。
(1)2Ca(OH)2+Cl2=CaCl2++Ca(ClO)2+2H2O
(2)SO2+2H2S=2H2O+3S
(3)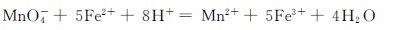
9.设计一个原电池,计算室温时,反应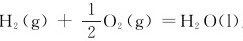 反应的平衡常数。
反应的平衡常数。
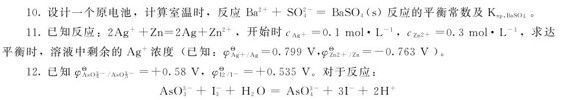
(1)判断上述反应在标准状态下的自发方向。
(2)计算反应的平衡常数。
(3)当溶液pH=7及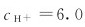 时,反应的方向。
时,反应的方向。
13.将铜片插入盛有0.5mol·L-1的CuSO4溶液的烧杯中,银片插入盛有0.5mol·L-1的AgNO3溶液的烧杯中,已知: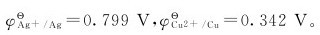
(1)写出该原电池的符号。
(2)写出电极反应式和原电池的电池反应。
(3)求该电池的电动势。
(4)若加氨水于CuSO4溶液中,电池电动势如何变化?若加氨水于AgNO3溶液中,情况又怎样?作定性回答。
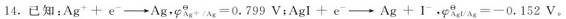
求:AgI在298K时的溶度积常数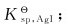 判断标准状态下金属Ag能否与HI(aq)发生置换反应。
判断标准状态下金属Ag能否与HI(aq)发生置换反应。
15.为什么Cu+在水溶液中不稳定,容易发生歧化反应?计算25℃时下列歧化反应的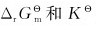 分别是多少:
分别是多少:
2Cu+=Cu2++Cu
16.铝空气电池是一种比较有希望的新能源,高纯铝作阳极,电解质是稀NaOH溶液,阴极由稳定的空气泡通过带有催化剂的惰性金属电极构成,电池反应为:

17.根据下面电势图(在酸性介质中):
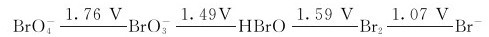
(1)写出能发生歧化反应的反应方程式;
(2)计算该反应的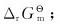
(3)计算该反应在298K时的标准平衡常数。
18.已知下面两个元素电极电势图:
(1)算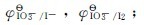
(2)指出电位图中哪些物质能发生歧化反应,并写出反应方程;
(3)从电极电势考虑,在酸性介质中HIO3与H2O2能否反应;
(4)从电极电势考虑,在酸性介质中I2与H2O2能否反应;
(5)综合考虑,(3)、(4)反应的最终结果是什么?
