3.5.2 标准平衡常数及化学反应等温式的热力学意义
在标准状态下,不同化学反应的标准摩尔吉布斯自由能变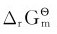 不同,这是由物质的本性决定的。当化学反应都是在标准状态下进行时,可用
不同,这是由物质的本性决定的。当化学反应都是在标准状态下进行时,可用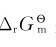 判断反应进行的方向:
判断反应进行的方向:
但是在大多数情况下,化学反应都是在非标准状态下进行的,在等温不做非体积功的前提下,应该用ΔrGm判断热化学反应自发过程的方向。根据化学反应等温式ΔrGm=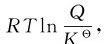 可以通过标准平衡常数与反应商大小的比较,简单地对反应平衡移动的方向进行分析判断:
可以通过标准平衡常数与反应商大小的比较,简单地对反应平衡移动的方向进行分析判断:
由此可见,根据Q值与K值的相对大小与根据ΔrGm值判断反应进行的方向所得的结论完全一致。因此,两者都可作为化学反应方向的判据。