习题
习题
一、是非题
1.在标准压力和温度下进行反应时,由最稳定的单质合成1mol某化合物的反应热,叫做该化合物的标准生成热。 ( )
2.碳的稳定单质是金刚石。 ( )

4.系统与环境无热量交换的变化为绝热过程。 ( )
5.赫斯定律认为化学反应的热效应与途径无关,是因为反应处在可逆条件下进行的缘故。 ( )
6.反应的ΔH就是反应的热效应。 ( )
7.功和热是系统和环境之间的两种能量传递方式,在系统内部不讨论功和热。 ( )
8.反应进度总是取正值。 ( )
9.放热反应均是自发反应。 ( )
10.内能和焓都是状态函数。 ( )
二、简答题
1.判断下列各过程中,哪个的ΔU最大。
(1)体系放出了60kJ热,并对环境做了40kJ功;
(2)体系吸收了60kJ热,环境对体系做了40kJ功;
(3)体系吸收了40kJ热,并对环境做了60kJ功;
(4)体系放出了40kJ热,环境对体系做了60kJ功。
2.下列纯物质中,哪些物质的标准摩尔生成焓不等于零。
(1)金刚石; (2)O3(g); (3)Br2(l); (4)Fe(s); (5)Hg(g); (6)石墨
3.指出下列各关系式成立的条件。
(1)ΔU=Qv;(2)ΔH=Qp;(3)ΔG=ΔH-TΔS
4.在标准状况下,CO2(g)的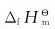 为下列哪个反应的
为下列哪个反应的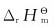 值?
值?
(1)C(金刚石)+O2(g)→CO2(g);
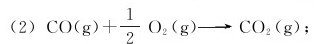
(3)C(石墨)+O2(g)→CO2(g)。
5.假设把一台冰箱放在一间密闭的房间里,把冰箱门打开,插上电源使冰箱工作。室内温度会怎样变化?为什么?
6.预测下列过程的熵变:
(1)NaCl熔融;
(2)建筑物坍塌;
(3)把空气分为温度、压力相同的氧气、氮气和氩气。
三、计算题
1.一热力学系统在等温定容的条件下发生变化时,放热15kJ,同时做电功35kJ。假设系统在发生变化时不做非体积功(其他条件不变),计算系统能放出多少热。
2.生物体内有机物的分解氧化对菌体的生长、营养的消耗十分重要。例如醋酸杆菌可通过乙醇氧化反应而获得生产所需要的能量,其过程分两步完成:
CH3CH2OH→CH3CHO→CH3COOH
请根据下列反应及其反应热计算生物体内乙醇被氧化成乙醛及乙醛被进一步氧化成乙酸的反应热。
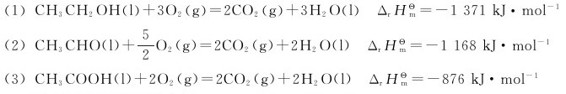
3.已知甲醇的标准燃烧热为-726.6kJ·mol-1,即
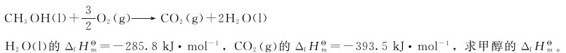
4.设有10molN2(g)和20molH2(g)在合成氨装置中混合,反应后有5molNH3(g)生成,试分别按下列反应方程式中各物质的化学计量数(νB)和物质的量的变化(ΔnB),计算反应进度并作出结论。
(1)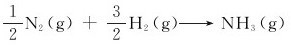
(2)N2(g)+3H2(g)→2NH3(g)
5.某汽缸中有气体1.20L,从环境吸收了800J热量后,在恒压(97.3kPa)下,体积膨胀到1.50L,试计算系统热力学能变化(ΔU)。
6.2.00mol理想气体在350K和152kPa的条件下,经恒压冷却至体积为35.0L,此过程放出热1260J。试计算:
(1)起始体积;(2)终态温度;(3)体系做功;(4)热力学能变化。
7.在一敞口试管内加热氯酸钾晶体时发生下列反应:2KClO3(s)→2KCl(s)+3O2(g),并放出热89.5kJ(298.15K)。求:298.15K下该反应的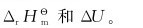
8.高炉炼铁,主要反应有:
C(s)+O2(g)→CO2(g)
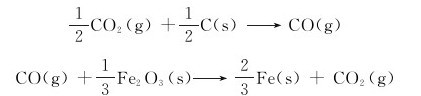
(1)分别计算298.15K时各反应的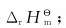
(2)将上列反应方程式合并成一个总反应方程式,应用各物质的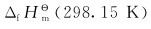 值计算总反应的
值计算总反应的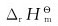 并与(1)计算结果比较做出结论。
并与(1)计算结果比较做出结论。
9.已知298.15K时:

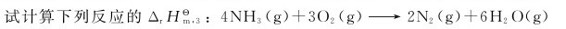
10.铝热法反应如下:
8Al+3Fe3O4→4Al2O3+9Fe
(1)利用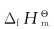 数据计算恒压反应热;
数据计算恒压反应热;
(2)在此反应中若用去267.0g铝,问能放出多少热量?
11.利用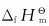 数据,试计算下列反应的恒压反应热:
数据,试计算下列反应的恒压反应热:
(1)Fe3O4+4H2(g)→3Fe(s)+4H2O(g)
(2)4NH3(g)+5O2(g)→4NO(g)+6H2O(g)
(3)3NO2(g)+H2O(l)→3HNO3(l)+NO(g)
12.已知AgH2O(s)+2HCl(g)→2AgCl(s)+H2O(l)

试求:AgCl的标准摩尔生成焓。
13.某天然气中CH4占85.0%,C2H6占10.0%,其余为不可燃部分。若已知
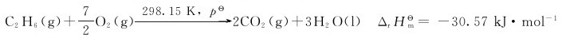
试计算完全燃烧1.00m3这种天然气的恒压反应热。
14.应用公式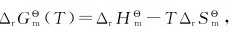 计算下列反应的值,并判断反应在298.15K及标准态下能否自发向右进行。
计算下列反应的值,并判断反应在298.15K及标准态下能否自发向右进行。
8Al(s)+3Fe3O4(s)→4Al2O3(s)+9Fe(s)
15.通过计算说明下列反应:
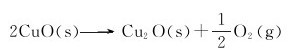
(1)在常温(298K)、标准态下能否自发进行?
(2)在700K、标准态下能否自发进行?
16.碘钨灯可提高白炽灯的发光效率并延长其使用寿命。其原理是由于灯管内所含少量碘发生了如下可逆反应,即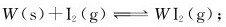 当生成的WI2(g)扩散到灯丝附近的高温区时,又会立即分解出W而重新沉积至灯管上。
当生成的WI2(g)扩散到灯丝附近的高温区时,又会立即分解出W而重新沉积至灯管上。

(1)若灯管壁温度为623K,计算上式反应的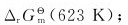
(2)求WI2(g)在灯丝上发生分解所需的最低温度。
17.试判断反应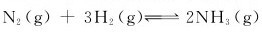 ,在298.15K、标准态下能否自发进行?
,在298.15K、标准态下能否自发进行?
18.求下列反应的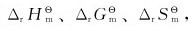 并用这些数据分析利用该反应净化汽车尾气中NO和CO的可能性。
并用这些数据分析利用该反应净化汽车尾气中NO和CO的可能性。

19.设汽车内燃机内温度因燃料燃烧反应达到1300℃,试估算此温度时下列反应的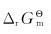 值。
值。
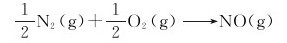
20.在298.15K下,已知两个化学反应:
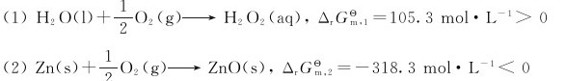
可知前者不能自发进行。若把两个反应耦合起来:
Zn(s)+H2O(l)+O2(g)→ZnO+H2O(aq)
不查热力学数据,请问此耦合反应在298.15K能否自发进行?为什么?
