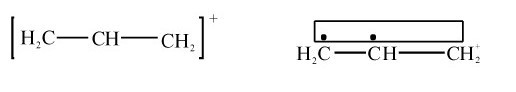7.5.4 离域π键
7.5.4 离域π键
价键理论讨论的分子中的共价键,无论是σ键还是π键,均是局限在两个原子范围内,这种键称为定域键。其中的σ键称为定域σ键,π键称为定域π键,但一般常将“定域”两字省略,简称σ键和π键。在多原子分子中,除构成分子骨架构型的定域σ键和π键外,分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动可形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,也称为大π键,它由3个或3个以上的原子所形成。离域π键用符号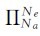 表示,其中Na表示参与形成离域π键的原子数,Ne表示形成离域π键的电子数。形成离域π键的条件是:①参与形成离域π键的原子都在同一个平面上。②每一个原子必须提供一个垂直于成键原子所在平面,且互相平行的p轨道。③成键原子提供的π电子总数小于p轨道数的2倍。
表示,其中Na表示参与形成离域π键的原子数,Ne表示形成离域π键的电子数。形成离域π键的条件是:①参与形成离域π键的原子都在同一个平面上。②每一个原子必须提供一个垂直于成键原子所在平面,且互相平行的p轨道。③成键原子提供的π电子总数小于p轨道数的2倍。
根据π电子数等于、大于或小于成键原子数,离域π键可分为正常离域π键、多电子离域π键和缺电子离域π键三种类型。
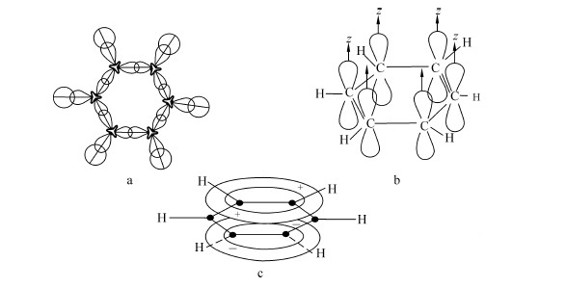
1.正常离域π键(Ne=Na) π电子数与成键原子数相等的离域π键称为正常离域π键,大多数的有机共轭分子中的离域π键都属于这一类型。例如,苯(C6H6)分子中,每个碳原子采用sp2杂化形成3个σ键,其中一个轨道与氢原子的1s轨道形成一个σ键,另外两个轨道与相邻的两个碳原子的sp2杂化轨道形成两个σ键,构成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间都可以相互重叠而形成六原子六电子离域π键 。苯的离域π键平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的,如图7.16所示。
。苯的离域π键平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的,如图7.16所示。
丁二烯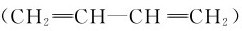 分子中4个碳原子均与3个原子相邻,故采用sp2杂化。这些杂化轨道相互重叠,形成分子σ骨架,故所有原子处于同一平面。每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里面有一个电子,含有四原子四电子离域π键
分子中4个碳原子均与3个原子相邻,故采用sp2杂化。这些杂化轨道相互重叠,形成分子σ骨架,故所有原子处于同一平面。每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里面有一个电子,含有四原子四电子离域π键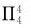 等。
等。
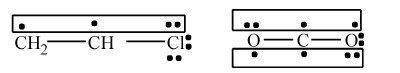
2.多电子离域π键(Ne>Na) π电子数大于成键原子数的离域π键,称为多电子离域π键。双键邻接带有孤对电子的O、N、Cl、S等原子,常形成多电子离域π键。例如,氯乙烯和二氧化碳分子中存在三原子四电子离域π键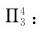
3.缺电子离域π键(Ne<Na) π电子数小于成键原子数的离域π键,称为缺电子离域π键。例如,丙烯阳离子中含有三原子两电子离域π键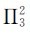 ,其价键结构可表示为:
,其价键结构可表示为: