9.5.4 砷、锑、铋的重要化合物
9.5.4 砷、锑、铋的重要化合物
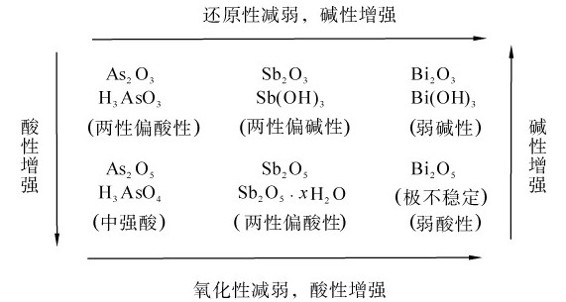
1.氧化物及其水合物 砷、锑、铋的氧化物及对应的水合物酸碱性归纳如下:
As2O3俗称砒霜,是剧毒的白色粉状固体,致死量为0.1g。As(Ⅲ)主要表现还原性,是较强的还原剂,它能还原像碘这样弱的氧化剂:
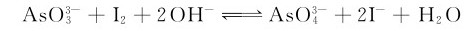
该反应方向受溶液pH值的控制。Bi(Ⅲ)需要强氧化剂才能将其氧化:
Bi(OH)3+Cl2+3NaOH=NaBiO3↓+2NaCl+3H2O
从As到Bi,其+5氧化态的氧化性依次增强。氧化态为+5的铋酸钠是一种很强的氧化剂,能把Mn2+离子氧化为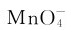 离子。
离子。
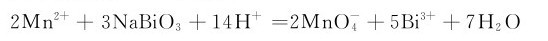
此反应可以用于鉴定Mn2+。
2.卤化物 砷、锑、铋所有三卤化物均已制得,已知的五卤化物有AsF5、SbF5、SbCl5和BiF5四种。砷、锑、铋的三卤化物在溶液中都会强烈地水解。例如卤化砷水解后生成相应的氢卤酸和亚砷酸:
AsX3+3H2O=H3AsO3+3HX
锑和铋的卤化物水解后生成难溶的锑和铋的酰基盐:
SbCl3+2H2O=SbOCl↓(氯化氧锑)+2HCl
BiCl3+2H2O=BiOCl↓(氯化氧铋)+2HCl
随着As、Sb、Bi碱性逐渐增强,其水解程度逐渐减弱。由于Sb(Ⅲ)和Bi(Ⅲ)的酰基盐是难溶的,所以锑和铋氧化态为+3的盐在常温时,水解进行得并不完全,通常就停留在酰基盐的阶段。
3.砷,锑,铋的硫化物和硫代酸盐 在砷、锑、铋的M(Ⅲ)盐溶液中或用强酸酸化后的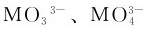 溶液中通入H2S,都可得到有颜色的相应的硫化物沉淀,如表9.7所示。
溶液中通入H2S,都可得到有颜色的相应的硫化物沉淀,如表9.7所示。
表9.7 砷、锑、铋硫化物的颜色和溶解性
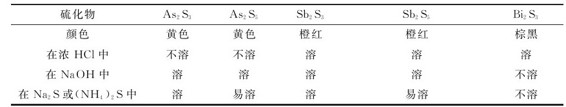
砷、锑、铋硫化物的酸碱性与相应的氧化物很相似。As2S3和Sb2S3显两性,前者两性偏酸性不溶于浓HCl,只溶于碱;而后者既溶于酸又溶于碱。Bi2S3显碱性,不溶于碱。
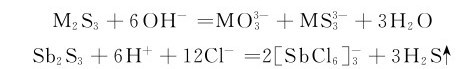
As2S3和Sb2S3还能溶于碱性硫化物如Na2S或(NH4)2S中,而Bi2S3不溶。
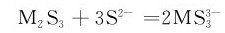
M2S5的酸性分别比相应的M2S3强,因此,M2S5比M2S3更易溶于碱性硫化物溶液中生成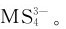
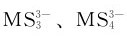 称为硫代酸盐,酸性条件下不稳定,分解放出H2S并析出硫化物:
称为硫代酸盐,酸性条件下不稳定,分解放出H2S并析出硫化物:
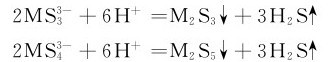
因此它们只能存在于中性或碱性介质中。利用上述反应在分析化学中用于这些元素的鉴定和分离。
