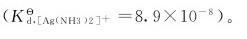习题
习题
一、是非题
1.在某些金属的难溶盐中,加入含有可与该金属离子配位的试剂时,有可能使金属难溶盐的溶解度增大。 ( )
2.含有配离子的配合物,其带异号电荷离子的内界和外界之间以离子键结合,在水中几乎完全解离成内界和外界。 ( )
3.具有一定稳定性的配离子在水溶液中的行为类似于弱电解质。 ( )
4.价键理论认为,配合物具有不同的空间构型是由于中心离子(或原子)采用不同杂化轨道与配体成键的结果。 ( )
5.以CN-为配体的配合物,往往较稳定。 ( )
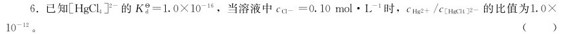
7.金属离子A3+、B2+可分别形成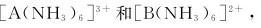 它们的稳定常数依次为4×105和2×1010,则相同浓度的[A(NH3)6]3+和[B(NH3)6]2+溶液中,A3+和B2+的浓度关系是
它们的稳定常数依次为4×105和2×1010,则相同浓度的[A(NH3)6]3+和[B(NH3)6]2+溶液中,A3+和B2+的浓度关系是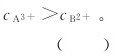
8.凡是配位数为4的配合物,其中心原子均采用sp3杂化轨道成键。 ( )
9.磁矩大的配合物,其稳定性强。 ( )
10.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。 ( )
二.选择题
1.下列叙述中正确的是( )。
(A)配合物中的配位键必定是由金属离子接受电子对形成的。
(B)配合物都有内界和外界。
(C)配位键的强度低于离子键或共价键。
(D)配合物中,形成体与配位原子间以配位键结合。

3.下列叙述中错误的是( )。
(A)配合物必定是含有配离子的化合物。
(B)配位键由配位体提供孤对电子,形成体接受孤对电子而形成。
(C)配合物的内界常比外界更不易解离。
(D)配位键与共价键没有本质区别。
4.25℃时,在Cu2+的氨水溶液中,平衡时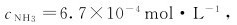 并认为有50%的Cu2+的形成了配离子[Cu(NH3)4]2+,余者以Cu2+形式存在。则[Cu(NH3)4]2+的不稳定常数为()。
并认为有50%的Cu2+的形成了配离子[Cu(NH3)4]2+,余者以Cu2+形式存在。则[Cu(NH3)4]2+的不稳定常数为()。
(A)4.5×10-7 (B)2.0×10-13 (C)6.7×10-4 (D)数据不足,无法确定
5.已知[Co(NH3)6]3+的磁矩μ=0B.M.,则下列关于该配合物的杂化方式及空间构型的叙述中正确的是()。
(A)sp3d2杂化,正八面体 (B)d2sp3杂化,正八面体
(C)sp3d2,三方棱柱 (D)d2sp2,四方锥
6.下列配离子中具有平面正方形空间构型的是()。
(A)[Ni(NH3)4]2+,μ=3.2B.M. (B)[CuCl4]2-,μ=2.0B.M.
(C)[Zn(NH3)4]2+,μ=0B.M.(D)[Ni(CN)4]2-,μ=0B.M.
7.已知[Ag(NH3)2]+的稳定常数为1.12×107。在含有0.20mol·L-1的[Ag(NH3)2]+和0.20mol·L-1NH3的混合溶液中,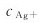 应为()。
应为()。
(A)4.5×10-7 (B)8.9×10-7 (C)1.8×10-8 (D)8.9×10-8
8.配位化合物形成时中心离子(或原子)轨道杂化成键,与简单二元化合物形成时中心原子轨道杂化成键的主要不同之处是:配位化合物形成时中心原子的轨道杂化()。
(A)一定要有d轨道参与杂化 (B)一定要激发成对电子成单后杂化
(C)一定要有空轨道参与杂化 (D)一定要未成对电子偶合后让出空轨道杂化
三、填充题(根据题意,在下列各题的横线处,填上正确的文字、符号或数值)
1.试比较下列各配离子的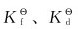 相对大小:
相对大小:
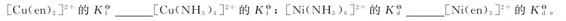
2.配合物[CoClNH3(en)2]Cl2的中心离子是___________;配离子是___________;配位体是___________;配位原子是___________。
3.配合物Ni(CO)4中配位体是___________;配位原子是___________;配位数是___________;命名为___________。
4.Fe2+的存在对于用NCS-鉴定Co2+会发生干扰,这是因为NCS-与Fe3+和CO2+能分别形成___________色和___________色的配合物,致使鉴定CO2+的反应现象难以观察清楚。如果先在溶液中加入足够量的NaF(或NH4F),则F-可与Fe3+生成更稳定的___________色配合物,NCS-便不再与Fe3+形成配合物,从而消除了对Co2+鉴定的干扰,这种方法称为离子的___________,在定性和定量分析中都有较多的应用。
5.Ni2+可形成平面正方形、四面体形和八面体形配合物,在这几种构型的配合物中,Ni2+采用的杂化方式依次是___________、___________和___________,其中磁矩为零的配合物相应的空间构型为。
四、问答题
1.试从配合物的结构理论等方面解释[Co(NH3)6]2+易在空气中氧化。
2.试用平衡理论实现并解释下列的转化:
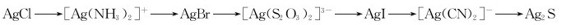
五、计算题
1.已知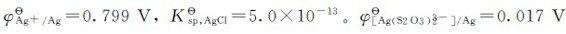 ,计算[Ag(S2O3)2]3-的稳定常数;若使0.10mol的AgBr固体完全溶解,Na2S2O3的最初浓度应为多少?
,计算[Ag(S2O3)2]3-的稳定常数;若使0.10mol的AgBr固体完全溶解,Na2S2O3的最初浓度应为多少?
2.将0.10mol·L-1AgNO3溶液与6.00mol·L-1氨水等体积混合,求混合溶液中Ag+、[Ag(NH3)2]+和氨水的浓度