习题
习题
1.计算激发态氢原子的电子从第三能级层跃迁至第二能级层时所辐射的光的频率、波长及能量各是多少?
2.判断下列叙述是否正确:
(1)电子具有波粒二象性,故每个电子既是粒子,又是波。 ( )
(2)电子的波性,是大量电子运动表现出的统计性规律的结果。 ( )
(3)波函数,即电子波的振幅。 ( )
(4)波函数即原子轨道,是描述电子空间运动状态的数学表达形式。 ( )
3.写出下列各轨道的名称:
(1)n=2 l=0;(2)n=3 l=2;
(3)n=4 l=1;(4)n=5 l=3.
4.下列量子数合理的是( )。


5.原子轨道角度分布图中,从原点到曲面的距离表示( )。
A.ψ的大小 B.Y绝对值的大小 C.r值的大小 D.4πr2dr值的大小
6.下列各元素原子的电子分布式各自违背了什么原理?请加以改正。
(1)B(1s22s3);
(2)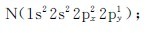
(3)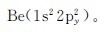
7.Li+、Na+、K+、Rb+、Cs+的基态的最外层电子组态与次外层电子组态分别如何?
8.已知电中性的基态原子的价电子层电子组态分别为:
(a)3s23p5 (b)3d64s2 (c)5s2 (d)5d106s1
试根据这个信息确定它们在周期表中属于哪个区?哪个族?哪个周期?
9.已知M2+的离子3d轨道中有5个d电子,请推出:该原子的核外电子排布、最外层和高能级组中电子数在周期表中的位置。
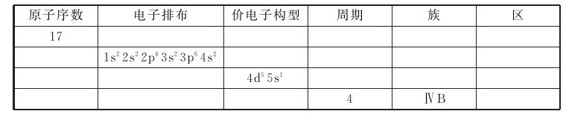
10.填充下表:
11.通过Slater规则计算说明,原子序数为12,16,25的元素中,4s和3d轨道哪个能量高?
12.具有下列原子外层电子结构的4种元素:
(1)2s2;(2)2s22p1;(3)2s22p3;(4)2s22p4.
其中第一电离能最大的是(),最小的是()。
13.已知数据如下表:

试从电子层结构和电离能数据,说明为什么钾的第一电离能小于钙,而第二电离能大于钙,并且在化学反应中钾表现为+1价,钙表现为+2价。
14.判断半径大小,并说明原因:
(1)Sr与Ba; (2)Ca与Sc; (3)Ni与Cu; (4)Zr与Hf; (5)S2-与S;
(6)Na+与Al; (7)Sn2+与Pb2+; (8)Fe2+与Fe3+。
15.镧系收缩的结果使下列元素性质相似的是 ( )。
A.Mn和Tc B.Ru和Rh C.Nb和Ta D.Zr和Hf
16.下列元素的第一电子亲和能大小正确的顺序是()。
A.C<N<O<F B.C>N>O>F C.C>N<O<F D.C>N<O>F
17.下列各组元素按电负性大小排列顺序正确的是: ( )。
A.F>N>O B.O<Cl<F C.As>P>H D.Cl>S>As
18.有A、B、C、D、E、F六种元素,试按下列条件推断各元素在周期表中的位置、元素符号,并给出各元素的价电子构型。
(1)A、B、C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D、E为非金属元素,与H结合形成HD和HE。室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
