5.2.1 原电池
1786年,伽伐尼(L.Galvani,1737—1798)在一次偶然的机会中发现,放在两块不同金属之间的青蛙腿会发生痉挛现象,他认为是一种生物电现象。1791年伏特得知了这一发现,对其产生极大兴趣,做了一系列实验,证明了只要两片不同的金属和溶液存在,不用动物体也可以有电产生。1800年,他又通过实验证明了此观点:将金属银和锌的小圆片分别重叠成堆,用食盐水浸透的厚纸片把金属堆隔开,在头尾金属片上连接导线,当两条导线接触时,产生火花放电。这就是科学史上著名的“伏特电堆”。
1836年英国化学家丹尼尔(J.F.Daniell,1790—1845)将不同的金属分别插在它们自己的金属离子溶液中组成半电池(half cell),中间通过盐桥将半电池连接,如图5.1所示,通过指针的偏向可以知道,电流由铜电极流向锌电极。这种利用氧化还原反应将化学能转变为电能的装置称为原电池(Pri-mary cell)。从理论上讲,任何自发进行的氧化还原反应都可以设计成原电池。
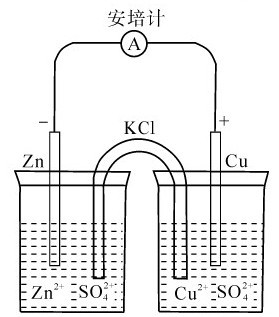
1.原电池的组成 原电池由两个半电池组成。在铜锌原电池中,Zn和ZnSO4溶液组成一个半电池,称为锌半电池;Cu和CuSO4溶液组成另一个半电池,称为铜半电池。半电池又称电极,每一个电极都是由电极导体和电解质溶液组成的。分别在两个半电池中发生的氧化反应或还原反应,称为半电池反应或电极反应。原电池的两极所发生的总的氧化还原反应称为电池反应。
在原电池中,流出电子的电极称为负极,负极发生氧化反应;流入电子的电极称为正极,正极发生还原反应。
在铜锌原电池中,电池反应为:Zn+Cu2++=Zn2++Cu。
铜电极为正极,发生还原反应:Cu2++2e-→Cu。
锌电极为负极,发生氧化反应:Zn→Zn2++2e-。
原电池中的盐桥是一支倒置的U形管,管中填满了用饱和KCl溶液(或NH4NO3溶液)和琼脂调制成的胶冻,这样KCl溶液不致流出,而阳离子和阴离子可以在其中自由移动。盐桥的作用是构成原电池的通路并维持溶液的电中性。
2.原电池的符号 为了简便起见,原电池装置常用原电池符号表示。书写原电池符号的规则如下:
(1)在半电池中,用“|”表示电极导体与电解质溶液之间的界面。
(2)原电池的负极写在左侧,正极写在右侧,并用“+”、“-”标明正极、负极,正极与负极用盐桥连接,盐桥用“‖”表示,盐桥两侧是两个电极的电解质溶液。若溶液中存在几种离子,离子间用逗号隔开。
(3)溶液要注明浓度,气体要注明分压力。
(4)如果电极中没有电极导体,必须外加一个惰性电极导体,惰性电极导体通常是不活泼的金属(如铂)或石墨。
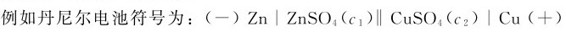
例5.1 将氧化还原反应:2KMnO4+5K2SO3+3H2SO4=2MnSO4+6K2SO4+3H2O设计成原电池,写出该原电池的符号及电极反应。
解:原电池的正极发生还原反应,负极发生氧化反应。因此组成原电池时,电对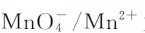 为正极,电对
为正极,电对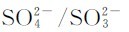 为负极。
为负极。
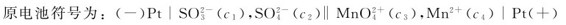
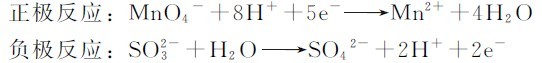
3.原电池的电动势与反应自由能的关系 从热力学讨论可以知道,在等温等压条件下,体系自由能的减少等于在等温等压下所做的最大有用功,即ΔrGT,P=-W非。
不同电极所产生的电极电势不同,若将两个不同的电极组成原电池时,两电极之间必然存在电势差,从而产生电流。在原电池中,正极的电极电势与负极的电极电势之差称为原电池的电动势。
Ecell=φ正-φ负 (5.1)
式中,Ecell为原电池的电动势;φ正为正极的电极电势;φ负为负极的电极电势。
在等温、等压条件下,系统的吉布斯自由能变等于系统所做的最大非体积功。对于电池反应来说,最大非体积功就是最大电功。
ΔrGT,P=-W非=-nEcellF (5.2)
式中,n为电池反应转移的电子的物质的量;Ecell是原电池的电动势;F是法拉第常数,其值为96484C·mol-1。
