7.8.1 离子晶体
离子晶体(ionic crystal)是在晶格结点上交替排列着阴阳离子,它们靠离子间静电引力——离子键维系着。几乎所有的盐类、强碱和强碱性氧化物都属此类晶体。
晶格中的每个离子都有规则地被异号离子所包围,例如NaCl晶体,在晶格中每个Na+被6个Cl-所包围,每个Cl-也被6个Na+所包围,阴、阳离子的配位数各为6,这样延伸到整个NaCl晶体。显然,在离子晶体中没有真正的“分子”存在。
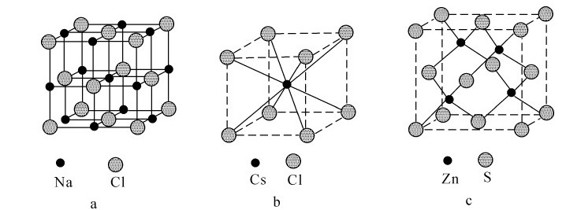
1.离子晶体的类型 在离子晶体中,由于各种阴、阳离子的半径比(r+/r-)不同,其配位数就不同,晶体内阴、阳离子的空间排布也不同,因而可得到不同类型的离子晶体。对于AB类型的离子晶体,最常见的是NaCl型、CsCl型和ZnS型*三种类型的晶体,配位数分别是6、8和4,它们晶胞形状都是正立方体。例如NaF、NaBr、MgO、KI、BaO、CaS等属于NaCl型;CsBr、CsI、TlCl等属于CsCl型;BeO、ZnSe等属于ZnS型(ZnS本身是共价化合物,但因某些AB型离子晶体内离子分布与其相似,结晶化学习惯上把此类型的离子晶体称为ZnS型)。图7.26示出了这三种晶体的结构形式,它们都是立方晶体结构。
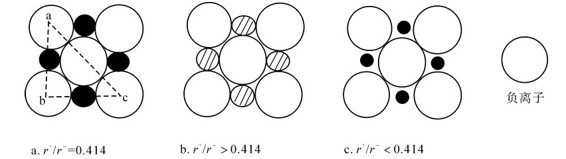
2.离子晶体的半径比规则 晶体要取得稳定结构,阴、阳离子一定要紧靠在一起,究竟靠紧到何种程度,这就取决于阴、阳离子的半径比(r+/r-),即半径决定了配位数,进而决定晶体类型。以配位数为6的晶体结构图的某一层为例,说明半径比r+/r-与配位数的关系。图7.27a中,令r-=1,则ac=4,ab=bc=2+2r+。
因为△abc是直角三角形,所以(ac)2=(ab)2+(bc)2 42=2(2+2r+)2
则r+=0.414。即r+/r-=0.414时,阴、阳离子直接接触,阴离子也两两接触。如果r+/r-<0.414,则出现图7.27c的情形,阴、阳离子不相接触,而阴离子互相接触,产生排斥。这样的构型不稳定,势必使晶体转入较小的配位数,如配位数为4的ZnS晶体。如果r+/r->0.414,阴离子不相接触,但阴、阳离子都能紧靠在一起,这样的构型稳定,如图7.27b所示。但当r+/r->0.732时,阳离子表面就可能紧靠上更多的阴离子,使配位数成为8,如CsCl晶体。配位数主要取决于正、负离子的半径比r+/r-,其比值越大,正离子吸引负离子的数目越多。
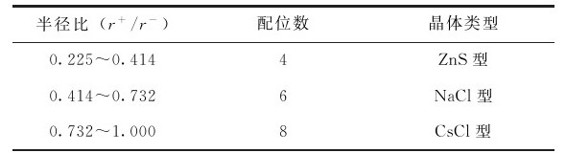
AB型晶体中,阳、阴离子半径比和晶体构型的关系列于表7.7。在离子晶体中,阳、阴离子的半径比与配位数、晶体构型的这种关系称为离子半径比规则。需要指出的是,离子半径比规则只适用于离子晶体。此外,晶体构型还受外界的影响。外界条件变化时,晶体构型也可能改变。例如,最简单的CsCl晶体,在常温下是CsCl型,但在高温下可以转变为NaCl型。这种化学组成相同而晶体构型不同的现象称为同质多晶现象。
表7.7 半径比与配位数的关系
3.离子晶体的特点 离子晶体中由于阴、阳离子的静电引力较强,有较大的晶格能,所以这类晶体具有以下特点:
(1)较高的熔点、沸点(NaCl、CaO的熔点分别是801℃、2570℃)。
(2)都易溶于水等极性溶剂。
(3)固态时离子被限制在晶格结点上振动,几乎不能导电,但在熔融状态或水溶液中是电的良导体。
(4)有较大的硬度(CaO、BeO的硬度分别是4.5、9.0)。
