3.5.1 化学反应等温式——范特霍夫方程
热力学证明,在等温等压非标准状态下,对于任一可逆反应:
aA+bB→gG+hH
若反应物和产物均为气体,则有
式中的Q为化学反应商,其表达式中各压力项指的是任意状态下的压力。对于溶液反应,则有:
式中各浓度项指任意状态下的浓度,纯液体或纯固体不写进Q的表达式中。
当反应达到平衡时,压力或浓度为平衡时的压力和浓度,故有Q=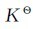 。且平衡时,有ΔrGm=0,代入式(3.36),则有
。且平衡时,有ΔrGm=0,代入式(3.36),则有
而非标准状态下化学反应的摩尔吉布斯自由能变ΔrGm与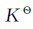 之间的关系为
之间的关系为
此式称为化学反应等温式,又称范特霍夫方程式(Van’t Hoff equation)。