9.2.2 s区元素单质的化学性质
2025年09月17日
9.2.2 s区元素单质的化学性质
单质的化学性质如下。
1.与水反应生成相应的碱和H2 室温下Li、Be、Mg反应较慢,其余的金属反应均剧烈。Na、K遇水可爆炸起火。
2.与空气反应 缓慢反应生成普通氧化物。燃烧时生成的产物分别为:Na→Na2O2;
Li→Li2O、Li3N;Mg→MgO、Mg3N2;K→KO2。除Mg、Be外,均不能存放于空气中。
3.与非金属反应 生成相应的离子化合物,如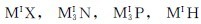 等。
等。
4.与液氨反应 碱金属和钙、锂、钡可溶于液氨,且均呈蓝色。在这种溶液中,碱金属离解生成溶剂合正离子和溶剂合电子:
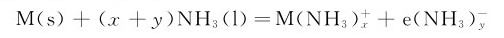
这种溶液具有很强的还原性。痕量杂质或光合作用可促使发生下述反应:
2Na+3NH3(l)=2NaNH2+H2(g)
5.与C2H5OH反应 2Na+2C2H5OH=2C2H5ONa+H2
6.汞齐的生成 Na易与Hg反应生成汞齐,在有机合成及工业中常被用作较缓和的还原剂。
7.锂的特殊性 锂尽管标准电极电势最小(-3.040V),但活泼性较其他碱金属小,这是由于锂的原子半径特别小造成的。
