9.4.3 过氧化氢
9.4.3 过氧化氢
9.4.3.1 过氧化氢的分子结构
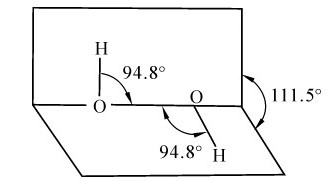
过氧化氢(hdroen peroxide)H2O2分子中有一个过氧链 存在,结构如图9.2所示。O—O键和O—H键的长度分别为147.5pm和95pm,键角∠HOO为94.8°,两个氢原子所在平面间的夹角为111.5°。
存在,结构如图9.2所示。O—O键和O—H键的长度分别为147.5pm和95pm,键角∠HOO为94.8°,两个氢原子所在平面间的夹角为111.5°。
9.4.3.2 过氧化氢的性质
纯的过氧化氢是无色黏稠液体,沸点为423K,凝固点为272K。固体密度(269K)为1.643g·cm-3,液体的密度(273K)为1.465g·cm-3,能以任意比与水混合。过氧化氢分子间存在较强的氢键,故在液态和固态中存在缔合分子,使其具有较高的熔沸点。过氧化氢的水溶液俗称双氧水,实验室中常用的过氧化氢为30%的水溶液。
过氧化氢的化学性质主要表现为对热不稳定性、强氧化性、弱还原性和极弱的酸性。
1.不稳定性 由于过氧基—O—O—内过氧键的键能较小,因此过氧化氢分子不稳定,易分解:
2H2O2(l)=2H2O(1)+O2(g)
极纯的过氧化氢相当稳定,90%的过氧化氢在323K时每小时仅分解0.001%,但426K时爆炸分解。过氧化氢在碱性介质中分解远比在酸性介质中快,微量杂质或重金属离子(Fe3+、Mn2+、Cr3+、Cu2+)、MnO2等及粗糙活性表面均能加速过氧化氢的分解。为防止过氧化氢分解,通常将其储存在光滑塑料瓶或棕色玻璃瓶中并置于阴凉处;若能再放入一些稳定剂,如微量的锡酸钠、焦磷酸钠和8-羟基喹啉等,则效果更好。
2.弱酸性
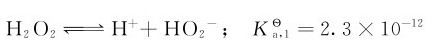
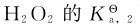 更小,其数量级约为10-25。
更小,其数量级约为10-25。
H2O2作为酸,可以与一些碱反应生成盐,即为过氧化物(peroxide),例如:
H2O2+Ba(OH)2=BaO2+2H2O
3.氧化还原性 在H2O2分子中,氧的氧化数为-1,处于中间状态,所以它既可做氧化剂又可做还原剂。在酸性介质中,过氧化氢是强氧化剂,而在碱性介质中只具有中等强度的还原性,因此过氧化氢主要作氧化剂。典型反应如:
PbS+4H2O2=PbSO4↓+4H2O
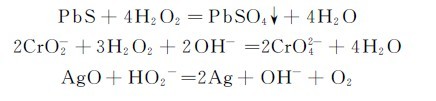
过氧化氢还原性较弱,只有遇到比它更强的氧化剂时才表现出还原性。例如:
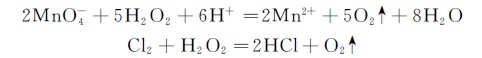
前一反应用来测定H2O2的含量,后一反应在工业上常用于除氯。
