4.3.2 盐效应、同离子效应对弱电解质解离平衡的影响
2025年09月17日
4.3.2 盐效应、同离子效应对弱电解质解离平衡的影响
解离平衡是弱电解质分子与离子之间存在着的动态平衡。它和所有化学平衡一样,当条件改变时,电离平衡就被破坏,平衡向一定的方向移动,直到建立起新的平衡。
弱电解质的电离平衡符合吕·查德里原理:当体系达到平衡后,若改变平衡状态的任一条件(如浓度、压力、温度),平衡就向着能减弱其改变的方向移动,主要表现为盐效应和同离子效应。
1.盐效应(Salt effect)
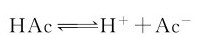
在上述反应中加入强电解质NaCl,平衡向解离的方向移动。说明在弱电解质溶液中加入强电解质时,该弱电解质的解离度将会略有增大,这种效应称为盐效应。其原因为加入强电解质后,使离子氛的作用更为明显,重新结合成弱电解质分子的概率减少。但盐效应引起的解离度的增大并不显著,在计算中可以忽略由盐效应引起的解离度的变化。
2.同离子效应(Common ion effect)
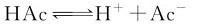
在以上溶液中加入醋酸钠固体(强电解质),溶液中Ac-离子大大增加,平衡向左移动。这种向弱电解质中加入具有相同离子(阳离子或阴离子)的强电解质后,解离平衡发生左移,造成弱电解质解离度降低的作用称为同离子效应。
盐效应和同离子效应共存时,常忽略盐效应,只考虑同离子效应。
例4.3 在0.1mol·L-1的NH3·H2O溶液中加入固体NH4Cl,使NH4Cl的浓度达到0.2mol·L-1,求该溶液中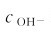 和解离度。
和解离度。
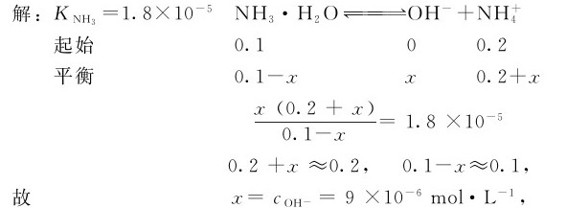
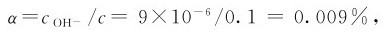 与例4.2相比较,NH3·H2O的解离度大大降低了。
与例4.2相比较,NH3·H2O的解离度大大降低了。
