7.3.3 等性杂化与不等性杂化
2025年09月17日
7.3.3 等性杂化与不等性杂化
前面几种杂化都是能量和成分完全等同的杂化,称为等性杂化(equivalent hybridiza-tion)。如果参加杂化的原子轨道中有不参加成键的孤对电子存在,杂化后所形成的杂化轨道的形状和能量不完全等同,这类杂化称为不等性杂化(nonequivalent hybridization)。例如:NH3分子中,N原子的价层电子构型为2s22p3,它的1个s轨道和3个p轨道杂化形成4个sp3杂化轨道,其中1个杂化轨道有一对成对电子,称为孤对电子(lone pair elec-tron),另外3个杂化轨道各有一个单电子与H原子的1s原子轨道重叠,单电子配对成键。由于孤对电子对另外3个成键的轨道有排斥压缩作用,致使NH3分子的键角不是109°28′,而是107°18′。NH3的几何构型是三角锥形,如图7.11a、b所示。
对于H2O分子,同样有两个杂化轨道被孤对电子占据,对成键的两个杂化轨道的排斥作用更大,以致两个O—H键间的夹角压缩成104°45′,所以水分子的几何构型呈“V”字形,如图7.11c所示。
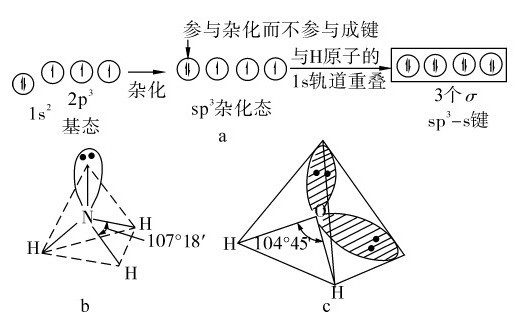
图7.11 NH
3,H
2O分子的几何构型
