习题
习题
一.是非题
1.中心离子电子构型为d1~d9的配离子大多具有颜色。 ( )
2.许多过渡元素的化合物因具有未成对电子而呈现顺磁性。 ( )
3.CrO5在戊醇中稳定性较强,并呈蓝色。 ( )
4.在酸性溶液中,KMnO4只能将H2S氧化为单质硫。 ( )
5.铁、钴、镍能被磁场强烈吸引,所以被称为顺磁性物质。 ( )
6.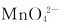 在酸性溶液中歧化的产物主要是
在酸性溶液中歧化的产物主要是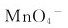 和MnO2。 ( )
和MnO2。 ( )
7.Ag2O是碱性氧化物,它在硝酸和盐酸中都能溶解。 ( )
二、选择题
1.在NaOH—H2O2混合溶液中,下列离子不能被氧化的是( )。
(A)Mn2+ (B)Fe3+ (C)[Co(NH3)6]2+ (D)Cr3+
2.下列锰的各氧化值的化合物在酸性溶液中最稳定的是( )。
(A)Mn(Ⅱ) (B)Mn(Ⅳ) (C)Mn(Ⅵ) (D)Mn(Ⅶ)
3.下列反应中,配离子作氧化剂的是( )。
(A)[Cu(OH)4]2-与甲醛反应 (B)[Fe(CN)6]4-与FeCl3反应 (C)[Co(NH3)6]2+与O2反应 (D)[Ag(NH3)2]+与KI反应
4.下列离子在酸性溶液中不能存在的是( )。
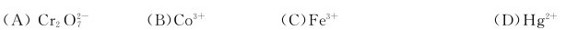
5.下列碘化物沉淀能溶于较浓的KI溶液而发生歧化的是( )。
(A)Hg2I2 (B)PbI2 (C)CuI (D)AgI
6.下列各组离子中互不反应,可以共存的是( )。

7.下列各种离子能在酸性溶液中稳定存在的是( )。

8.下列各组离子中的所有离子都能将I-氧化的是( )。

9.用下列试剂鉴别Hg(NO3)2和Hg2(NO3)2两种溶液,可选用的是( )
(A)Sn(NO3)4 (B)HNO3 (C)NaCl (D)FeSO4
10.下列氢氧化物中,溶于过量氨水(必要时可加NH4Cl)后又易被氧化的是( )。
(A)Ni(OH)2 (B)Co(OH)2 (C)Cu(OH)2 (D)Zn(OH)2
三、填充题
下列各种离子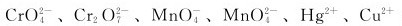 在酸性条件下,氧化性最强的是_________,能歧化的是_________,能与H2O2在酸性条件下形成过氧化物的是_________,没有颜色的是_________。
在酸性条件下,氧化性最强的是_________,能歧化的是_________,能与H2O2在酸性条件下形成过氧化物的是_________,没有颜色的是_________。
2.在含有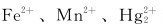 的溶液中加入NaOH溶液,搅拌并放置一段时间,其最终产物分别为_________、_________、_________和_________。
的溶液中加入NaOH溶液,搅拌并放置一段时间,其最终产物分别为_________、_________、_________和_________。
3.Pb(NO3)溶液与K2Cr2O7溶液混合会生成_________色的_________,再加入过量NaOH溶液则得到_________色溶液,其中Pb(Ⅱ)以_________形式存在。
4.CuCl与NH3·H2O反应得到的溶液放置一定时间后呈蓝色,这是因为_________色的[Cu(NH3)2]+具有_________性,它能与空气中的_________反应生成_________的缘故。
四、完成下列反应方程式
1.氢氧化钴(Ⅱ)暴露在空气中。
2.在硫酸铜溶液中加入过量的NaOH溶液和葡萄糖并加热。
3.硫化汞溶于王水中。
4.氧化亚铜与稀盐酸反应。
5.向Hg(NO3)2溶液中滴加KI溶液。
6.向Na2SO3与NaOH混合溶液中滴加KMnO4溶液。
7.用浓盐酸处理三氧化二钴。
五、问答题
1.如何区分AgCl和HgCl2?设计两种方法,加以简要说明。写出相应的反应方程式。
2.有肉色溶液A,当与NaOH溶液反应时生成不溶于水的白色沉淀B,B在空气中慢慢变成棕色物质C;C不溶于碱,但当它与浓盐酸作用时生成黄绿色气体D,D能使淀粉碘化钾试纸变蓝;将C与KClO3和碱共熔得绿色化合物E,E和D作用得具有氧化性的紫色物质F。指出A、B、C、D、E、F各为何物?
六、计算题

(1)判断酸性溶液中Co2+能否与溴水发生反应。
(2)判断碱性溶液中Co(OH)2与溴水的反应能否发生。若反应可以进行,计算反应的标准平衡常数。
2.已知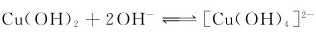 的标准平衡常数
的标准平衡常数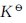 =1.7×10-3,[Cu(OH)2]的
=1.7×10-3,[Cu(OH)2]的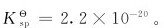
(1)计算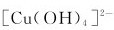 的标准稳定常数
的标准稳定常数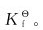
(2)若使0.10molCu(OH)2刚好全部溶解在1.0LNaOH溶液中,则NaOH溶液的初始浓度至少应为多少?
