5.4.2 电势-pH图
5.4.2 电势-pH图
许多氧化还原反应是在水溶液中进行的,当有H+或OH-参与电极反应时,溶液pH的改变能引起电对的电极电势的变化。如果浓度、温度一定,氧化还原电对的电极电势仅与溶液的pH值有关。在一定温度、浓度的条件下,以氧化还原电对的电极电势为纵坐标,溶液的pH值为横坐标作图,所得图形称为电势-pH图。
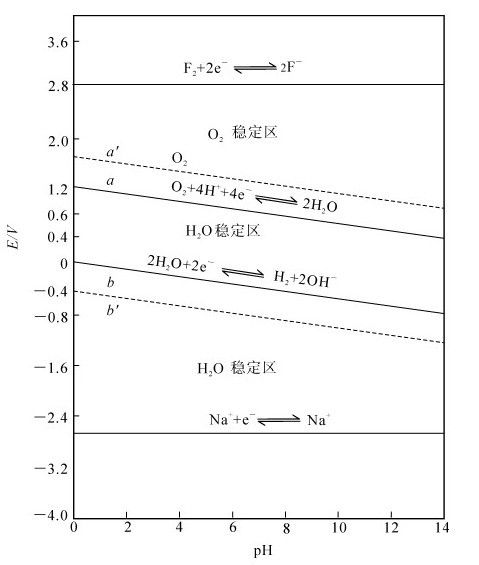
水本身既具有氧化性又具有还原性,水的电势-pH图如图5.5所示。
在酸性介质中:
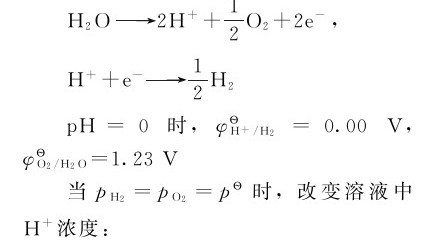
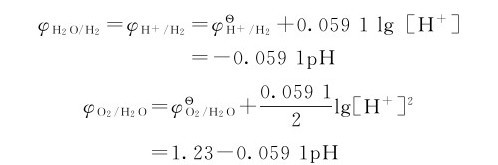
可见,H2O作为氧化剂或还原剂时,两个电对的电极电势都与溶液pH有关。
如图5.5所示,a线表示电对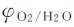 的电极电势随着pH的改变而变化的情况;b线表示电对
的电极电势随着pH的改变而变化的情况;b线表示电对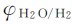 的电极电势随着pH的改变而变化的情况。由于实际放电速率缓慢,致使a线和b线分别比理论值较高和较低,即为a′线和b′线。
的电极电势随着pH的改变而变化的情况。由于实际放电速率缓慢,致使a线和b线分别比理论值较高和较低,即为a′线和b′线。
若电极反应中没有H+或OH-参与,则氧化还原电对的电极电势不受溶液酸碱度的影响,作图可以得到平行线。如图5.5中电对F2/F-和Na+/Na的电势-pH线均为平行线。
在水溶液中,若有一种强氧化剂,其所在电对的电极电势高于a′线,它就可以氧化H2O放出O2。所以在a′线上方区域中,H2O不稳定,而O2稳定,为O2的稳定区。
在水溶液中,若有一种还原剂,其所在电对的电极电势低于b′线,它就可以还原H2O放出H2。所以在b′下方区域中,H2O不稳定,而H2稳定,为H2的稳定区。
在水溶液中,若氧化剂所在电对的电极电势低于a′线,或还原剂所在电对的电极电势高于b′线,则水既不能被氧化,也不能被还原,氧化剂和还原剂在水溶液中均能稳定存在。所以在a′线和b′线之间,是H2O的稳定区,H2和O2在此区域内都不稳定。
例如,电对F2/F-的电势-pH线位于a′线上方,因此氧化态的F2能与H2O反应放出O2:
2F2+2H2O=4HF+O2↑。
同理,电对Na+/Na的电势-pH曲线位于b′线下方,因此还原态的Na能与H2O反应放出H2:
2Na+2H2O=2Na++2OH-+H2↑
上述讨论表明,制备F2必须用熔盐电解法,而不能在水溶液中进行;用钠做还原剂时,反应不能在水溶液中进行,必须以液氨或无水乙醚做溶剂。
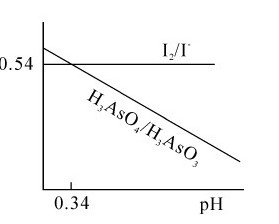
例5.10 讨论反应H3AsO4+2I-+2H+→H3AsO3+I2+H2O在不同酸度时化学反应的方向。
解:上述反应涉及两个半反应或两个电对,其中氧化半反应:2I-—2e-=I2,其电势不受pH值的变化所影响,若相关物种均处于标准态,则:
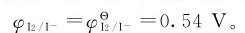
而还原半反应:H3AsO4+2H++2e-=H3AsO3+H2O,显然它与溶液的pH值有关。
假定[H3AsO4]=[H3AsO3]=1.0mol·L-1,代入能斯特方程进行计算,得到电对:
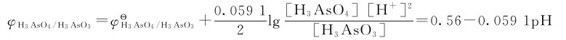
以φ对pH作图可以得到如图5.6所示的该反应所涉及的电对I2/I-和H3AsO4/H3AsO3两个电对的电势图。
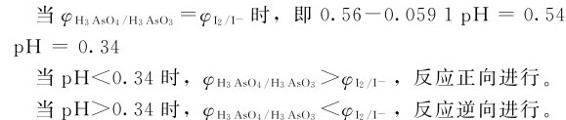
从以上讨论可知,利用电势-pH图,可以通过控制溶液的pH值来控制氧化还原反应的方向,为实际生产服务。