2.3.1 过程的自发性
自然界发生的过程都有一定的方向性,例如水总是从高处向低处流,水位差(Δh)为判据,当Δh=0时,水流停止而不会自动地反方向流动。热从高温物体向低温物体传递,判据为ΔT,当ΔT=0时,达到平衡。充满高压的轮胎,如果扎一个小孔,轮胎就会瘪下来,压力差(Δp)为判据。对于化学反应:Zn+CuSO4(aq)=ZnSO4(aq)+Cu构成的电池,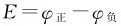 为判据,当E=0时,达到平衡。这种在一定条件下不需要外界做功、不受外界干扰(-W′=0)而能自动发生且进行下去的过程叫做自发过程(spon-taneous processes);自发过程都具有明确的方向和限度。
为判据,当E=0时,达到平衡。这种在一定条件下不需要外界做功、不受外界干扰(-W′=0)而能自动发生且进行下去的过程叫做自发过程(spon-taneous processes);自发过程都具有明确的方向和限度。
要使非自发过程得以进行,外界必须做功。例如欲使水从低处输送到高处,可借助水泵做机械功来实现。又例如常温下水虽然不能自发地分解为氢气和氧气,但是可以通过电解强行使水分解。必须提及,能自发进行的反应,并不意味着其反应速率一定很大。事实上,有些自发反应其反应速率的确很大;而有些自发反应,其反应速率却很小。例如氢和氧化合成水的反应在室温下其反应速率很小,但只要点燃或加入微量铂绒,即可发生爆炸性反应。
化学反应在指定条件下自发进行的方向和限度(或可能进行的程度),是科学研究和生产实践中极为重要的理论问题之一。
能否从理论上判断一个化学反应是否为自发反应呢?或者说从理论上确立一个化学反应方向的判据呢?热力学第二定律给人们提供了一个判定自然界中发生的一切物理过程和化学过程方向和限度的依据。
2.3.1.1 焓变和熵变对自发过程的影响
1.焓变对自发过程的影响 在研究各种体系的变化过程时,人们发现自然界的自发过程一般都朝着能量降低的方向进行。化学反应亦符合上述能量最低原理。很多放热反应,在298.15K、标准态下是自发的,例如:
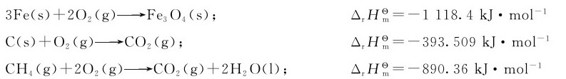
由于上述现象的存在,有人曾试图以反应的焓变(ΔrHm)作为反应自发性的判据。认为在等温等压条件下,当ΔrHm<0时,化学反应自发进行;当ΔrHm>0时,化学反应不能自发进行。但是实践表明:有些吸热过程(ΔrHm>0)亦能自发进行。例如,水的蒸发、NH4Cl溶于水,以及Ag2O的分解等都是吸热过程,在298.15K、标准态下均能自发进行:
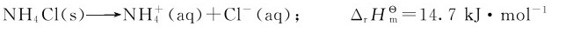
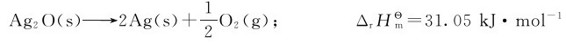
又如,CaCO3的分解反应是吸热反应(ΔrHm>0)
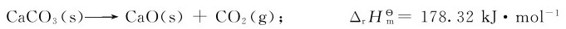
在298.15K、标准态下反应是非自发的;但当温度升高到约1123K时,CaCO3的分解反应就变成自发过程,而此时反应的焓变仍近似等于178.32kJ·mol-1(温度对焓变影响甚小)。由此可见,把焓变作为反应自发性的普遍判据是不准确、不全面的。
2.熵变对自发过程的影响 为什么有些吸热过程亦能自发进行呢?这里以NH4Cl的溶解和Ag2O的分解为例说明。NH4Cl晶体中的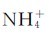 和Cl-在晶体中的排列是整齐、有序的,NH4C1晶体投入水中后,形成水合离子(以aq表示)并在水中扩散。在NH4Cl溶液中,无论是
和Cl-在晶体中的排列是整齐、有序的,NH4C1晶体投入水中后,形成水合离子(以aq表示)并在水中扩散。在NH4Cl溶液中,无论是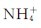 (aq)、Cl-(aq),还是水分子,它们的分布情况都比NH4Cl溶解前要混乱得多。
(aq)、Cl-(aq),还是水分子,它们的分布情况都比NH4Cl溶解前要混乱得多。
又如Ag2O的分解过程,其分解反应式表明,反应前后对比,不但物质的种类和“物质的量”增多,更重要的是产生了热运动自由度很大的气体,整个物质体系的混乱程度增大了。由此可见,自然界中的物理和化学的自发过程一般都朝着混乱程度(简称混乱度)增大的方向进行。
1856年,德国的物理学家克劳休斯(Clauius R.J.E.)引进了一个表示系统内部粒子运动混乱程度的物理量——熵(entropy)。从微观上讲,熵与体系的微观状态有关,在一定条件下能作为自发过程判断的依据。若以Ω表示微观状态数,则有:
S=klnΩ (2.8)
式中的k=1.38×10-23J·K-1,为玻尔兹曼(Boltzmann)常量。
(1)熵变的性质:熵和热力学能(U)、焓变(H)一样是状态函数,有加和性,具有容量性质。
(2)熵变的物理意义:是体系混乱度的量度。S越大,混乱度越高;S越小,构成物质的微粒排列越整齐有序。
(3)熵变的绝对值:和热力学能(U)与焓变(H)不同,熵变的绝对值是可以得到的。
宏观上的熵的变化ΔS的定义为:可逆过程中体系吸收的热量Qr除以热传递时的温度。

该式把与体系微观状态有关的变量ΔS和宏观物理量Qr联系了起来。
自发过程总是向混乱度增加的方向进行,即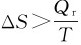 。就孤立系统而言,它只能发生ΔS孤立≥0的变化,这就是熵增加原理。
。就孤立系统而言,它只能发生ΔS孤立≥0的变化,这就是熵增加原理。
虽然熵增加有利于反应的自发进行,但是与反应焓变一样,不能仅用熵变作为反应自发性的判据。例如SO2(g)氧化为SO3(g)的反应,在298.15K、标准态下是一个自发反应,但其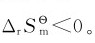 又如水转化为冰的过程,其
又如水转化为冰的过程,其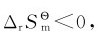 但在T<273.15K的条件下却是自发过程。这表明过程(或反应)的自发性不仅与焓变和熵变有关,而且还与温度条件有关:
但在T<273.15K的条件下却是自发过程。这表明过程(或反应)的自发性不仅与焓变和熵变有关,而且还与温度条件有关:
1)当ΔH=0时,ΔS>0是过程自发的判据。
2)当ΔS=0时,ΔH<0是过程自发的判据。
2.3.1.2 热力学第三定律
1.热力学第三定律的内容 在绝对零度(0K)时,任何排列整齐的理想晶体的熵值为零,即S0=0。
2.绝对熵 在温度T时的熵值,即为绝对熵,利用热力学数据,就可以计算出任意物质在各种状态(物态、温度、压力)的绝对熵。
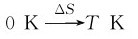
状态Ⅰ 状态Ⅱ
S0 ST
ΔS=ST-S0=ST (2.10)
其中ST为绝对熵。
3.标准摩尔熵 各种物质在标准状态下的摩尔绝对熵,定义为该物质的标准摩尔熵。表2.2所示为一些物质的标准摩尔熵。
各种物质在标准状态下的摩尔绝对熵,定义为该物质的标准摩尔熵。表2.2所示为一些物质的标准摩尔熵。
表2.2 一些物质的标准摩尔熵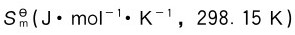
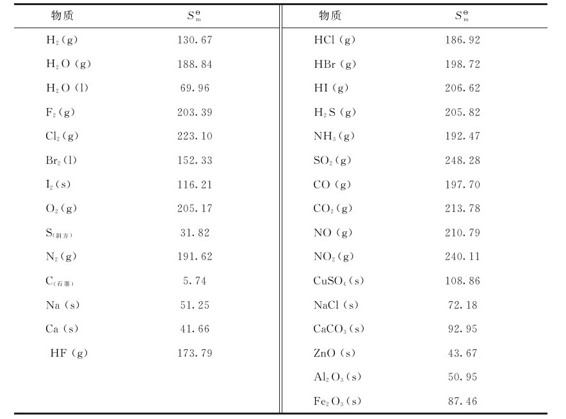
化学反应的熵变(ΔrSm)与焓变(ΔrHm)的计算原则相同,只取决于反应的始态和终态,而与变化的途径无关。因此应用标准摩尔熵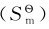 的数值可以算出化学反应的标准摩尔反应熵变
的数值可以算出化学反应的标准摩尔反应熵变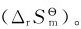 对于任意化学反应:αA+βB=γC+δD
对于任意化学反应:αA+βB=γC+δD
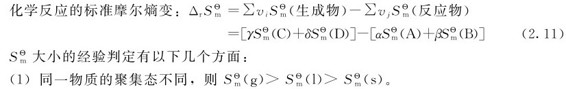
(2)同聚集态物质的摩尔质量M越大,则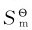 越大。
越大。
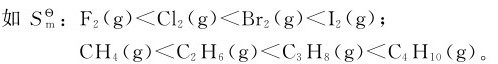
(3)摩尔质量相同的不同物质,结构越复杂,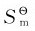 值越大,如乙醇和二甲醚。因为二甲醚分子的对称性高于前者,故其
值越大,如乙醇和二甲醚。因为二甲醚分子的对称性高于前者,故其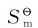 值前者大于后者。
值前者大于后者。
(4)同一物质的熵值随着温度的升高而增大。如CS2(L)在和时,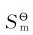 分别为103J·mol-1·K-1和150J·mol-1·K-1。
分别为103J·mol-1·K-1和150J·mol-1·K-1。
(5)压力对固态和液态物质的熵值影响较小,而对气态物质的熵值影响较大,压力越大,微粒运动的自由度越小,熵越小。
例2.7 计算反应:2SO2(g)+O2(g)=2SO3(g)在298.15K时的标准摩尔熵变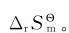
解:由附录查得:2SO2(g)+O2(g)=2SO3(g)

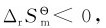 故在298.15K标准态下该反应为熵值减小的反应。
故在298.15K标准态下该反应为熵值减小的反应。
除查标准熵表外,定性判断熵变的增减,也是很有实际意义的。例如:
(1)由固体变成液体气体的反应:ΔS>0,如:CaCO3(s)=CaO(s)+CO2(g)。
(2)由气体分子少变成气体分子多的反应:ΔS>0,如: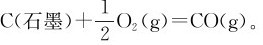
判断了ΔS的正负,再结合ΔH,对判断化学反应方向极有意义。
