习题
习题
1.写出下列各酸(或碱)的共轭碱(或共轭酸)。
(1)HCN、HNO2、HF、HIO3、H3PO4;
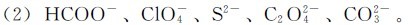
2.计算下列溶液的pH。
(1)0.2mol·L-1HClO4;
(2)将50mL0.10mol·L-1的HI溶液稀释至1.0L;
(3)将pH为8.00和10.00的NaOH溶液等体积混合;
(4)将pH为2.00的强酸和pH为13.00的强碱溶液等体积混合。
3.阿司匹林的有效成分是乙酰水杨酸HC9H7O4,其Ka=3.0×10-4。在水中溶解0.65g乙酰水杨酸,最后稀释至65mL,计算该溶液的pH。
4.在298K时,已知0.10mol·L-1的某一元弱酸水溶液的pH为3.00,试计算:
(1)该酸的解离常数;(2)该酸的解离度;
(3)将该酸溶液稀释一倍后的Ka、α及pH。
5.欲配制pH=5.0的缓冲溶液,须称取多少克NaAc·3H2O固体溶解在300mL0.5mol·L-1的HAc溶液中?
6.某溶液含有Fe3+和Fe2+,其浓度均为0.050mol·L-1,要求Fe(OH)3沉淀而不生成Fe(OH)2沉淀,须控制pH在什么范围?
7.计算下列溶液的pH。
(1)0.20mol·L-1HAc和0.10mol·L-1NaOH等体积混合;
(2)0.20mol·L-1HAc和0.20mol·L-1NaOH等体积混合;
(3)0.20mol·L-1NaAc和0.10mol·L-1HCl等体积混合。
8.根据AgI的溶度积,计算:
(1)AgI在纯水中的溶解度(g·L-1);
(2)在0.001mol·L-1KI溶液中AgI的溶解度(g·L-1);
(3)在0.010mol·L-1AgNO3溶液中AgI的溶解度(g·L-1)。
9.1g的FeS固体能否溶于100mL1.0mol·L-1的盐酸溶液中?已知FeS的溶度积常数为6.0×10-18,H2S的总电离平衡常数为9.23×10-22,相对分子质量MFeS=87.9。
10.某一元弱酸HA的浓度为0.010mol·L-1,在常温下测得其pH为4.0。求该一元弱酸的解离常数和解离度。
11.在含有0.50mol·L-1MgCl2溶液中加入等体积的0.10mol·L-1氨水,能否产生Mg(OH)2沉淀?若氨水中同时含有0.02mol·L-1的NH4Cl,能否产生沉淀?若使Mg(OH)2恰好不产生沉淀,须再加入NH4Cl多少克?
12.某溶液中含有Pb2+和Zn2+,两者的浓度均为0.10mol·L-1。在室温下通入H2S气体使之成为H2S饱和溶液,并加HCl控制S2-浓度。为了使PbS沉淀出来,而Zn2+仍留在溶液中,则溶液中的H+浓度最低应是多少?此时溶液中的Pb2+是否被沉淀完全?
13.在离子浓度各为0.1mol·L-1的Fe3+、Cu2+、H+等离子的溶液中,是否会生成铁和铜的氢氧化物沉淀?当向溶液中逐滴加入NaOH溶液时(设总体积不变),能否将Fe3++、Cu2+离子分离。
14.将100mL0.02mol·L-1MnCl2与100mL0.01mol·L-1含NH4Cl的氨水溶液相混合,计算此混合溶液中NH4Cl的浓度最低达多少时才不致生成Mn(OH)2。
15.在氯离子和铬酸根离子浓度均为0.100mol·L-1的混合溶液中逐滴加入AgNO3溶液(忽略体积的变化)时,AgCl和Ag2CrO4哪一种先沉淀?当Ag2CrO4开始沉淀时,溶液中氯离子的浓度为多少?
16.用NaOH溶液来处理MgCO3沉淀,使之转化为Mg(OH)2沉淀,计算这一转化反应的标准平衡常数。若0.0045molMgCO3沉淀在1.0LNaOH溶液中转化为Mg(OH)2沉淀,此NaOH溶液的最初浓度至少应为多少?
17.在血液中,H2CO3—NaHCO3缓冲对的作用之一是从细胞组织中迅速除去由运动产生的乳酸(简记为HL)。
(1)求 的平衡常数。
的平衡常数。
(2)若血液中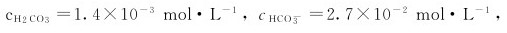 求血液的pH值。
求血液的pH值。
(3)向1.0L血液中加入5.0×10-3molHL后pH为多大?
(已知H2CO3:Ka1=4.2×10-7,Ka2=5.6×10-11;HL:Ka=1.4×10-4)
