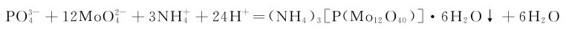9.5.3 磷的含氧酸及其盐
2025年09月17日
9.5.3 磷的含氧酸及其盐
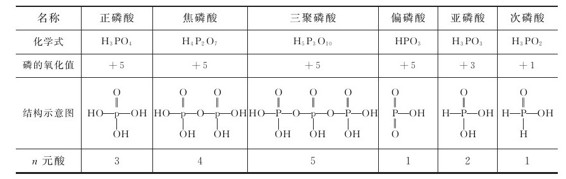
1.磷的含氧酸类型 磷的含氧酸有多种形式,较重要的见表9.6。
表9.6 磷的含氧酸
正磷酸简称为磷酸(phosphoric acid),它由一个单一的磷氧四面体构成,其结构与H2SO4相近。P—O键可以成双键,由一个σ键和两个p-dπ键构成。
纯净的磷酸为无色晶体,熔点315K。市售磷酸是黏稠的浓溶液,质量百分含量约为85%。磷酸是一种无氧化性的不挥发的三元中强酸,在298K时,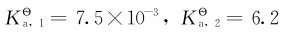
磷酸有很强的配合能力,它可以和许多金属离子形成配合物。在分析化学中,为了掩蔽Fe3+离子(浅黄色)的干扰,常用H3PO4与Fe3+离子形成无色可溶性的配合物H3[Fe(PO4)2]、H[Fe(HPO4)2]等。
2.磷酸盐 正磷酸能生成3个系列的盐:M3PO4、M2HPO4和MH2PO4(M是+1价金属离子)。所有的磷酸二氢盐(dihydric phosphate)都易溶于水,而磷酸一氢盐(hydrophosphate)和正盐(phosphate)除了K+、Na+和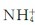 离子的盐外,一般不溶于水。如:Ca3(PO4)2难溶解,CaHPO4微溶,Ca(H2PO4)2易溶。
离子的盐外,一般不溶于水。如:Ca3(PO4)2难溶解,CaHPO4微溶,Ca(H2PO4)2易溶。
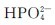 和
和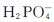 在水溶液中除能发生水解外,同时还发生解离,其水溶液的酸碱性则由水解和电离这两种行为共同决定。
在水溶液中除能发生水解外,同时还发生解离,其水溶液的酸碱性则由水解和电离这两种行为共同决定。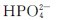 的水解程度大于其电离程度,故
的水解程度大于其电离程度,故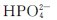 水溶液呈弱碱性;
水溶液呈弱碱性;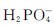 的水解程度小于其电离程度,故
的水解程度小于其电离程度,故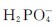 水溶液呈弱酸性。
水溶液呈弱酸性。
磷酸盐与过量的钼酸铵在浓硝酸介质中反应有淡黄色磷钼酸铵晶体析出,这是鉴定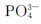 离子的特征反应:
离子的特征反应: