4.4.3 缓冲溶液的选择与配制
4.4.3 缓冲溶液的选择与配制
1.缓冲溶液的选择
(1)选择的缓冲对不能与要进行反应的反应物或生成物发生作用。配制药用缓冲溶液时还应考虑溶液的毒性。
(2)每个缓冲对都有一个特定的缓冲有效范围。根据实际工作要求选择不同的缓冲对,其pKa、pKb应尽量靠近要配制的缓冲溶液的pH值或pOH值,最大差别不要超过1。
例如:欲配制pH=7.00的缓冲溶液500mL,HCOOH—HCOONa、HAc—NaAc、NaH2PO4—Na2HPO4、NH3—NH4Cl四个缓冲对中,pKa分别等于3.74、4.74、7.20、9.26,这时就应选择NaH2PO4—Na2HPO4配制缓冲溶液。
(3)利用缓冲溶液计算公式,先推算出缓冲对的浓度比,再根据所需配制溶液的体积,计算所需的量。
2.缓冲溶液的配制 实验室中配制缓冲溶液的几种常用方法如下:
(1)向一定量的弱酸、弱碱溶液中加入固体盐进行配制。
例4.7 配制1.0LpH=9.80,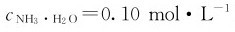 的缓冲溶液,需要6.0mol·L-1的NH3·H2O多少毫升和固体(NH4)2SO4多少克?
的缓冲溶液,需要6.0mol·L-1的NH3·H2O多少毫升和固体(NH4)2SO4多少克?
解:此缓冲溶液为碱性,用式(4.16)计算,须加入固体(NH4)2SO4的质量为:
0.028×132×1.0=1.8(g)
配制方法:称取1.8g固体(NH4)2SO4溶于少量水中,加入0.017L6.0mol·L-1的NH3·H2O,然后加水稀释至1.0L即可。
(2)用相同浓度的弱酸(或弱碱)及盐溶液,按不同体积互相混合。
例4.8 浓度均为0.10mol·L-1的HAc和NaAc溶液,如何配制1.0L,pH=5的缓冲溶液?
解:利用式(4.16)计算缓冲溶液pH值。设HAc的体积为Va,NaAc的体积为Vb,计算得出Va=0.36L,Vb=0.64L。
配制方法:量取360mL0.10mol·L-1的HAc溶液和640mL0.10mol·L-1的NaAc溶液混合均匀,即配制成pH=5.0的缓冲溶液。
(3)在一定的弱酸(碱)中加入一定量的强碱(酸),通过中和反应生成的盐和剩余的弱酸(碱)组成缓冲溶液。
例4.9 欲配制pH=5.0的缓冲溶液,如果用0.10mol·L-1的HAc溶液100mL,应加入相同浓度的NaOH溶液体积多少才能制成这种缓冲溶液?
解:此溶液的缓冲对应为:HAc—NaAc,而不是HA—NaOH。NaAc的来源是NaOH和HAc发生中和反应的产物。HAc未反应完,因此估算NaOH所加的体积应小于100mL。
HAc+NaOH=NaAc+H2O
设加入xmLNaOH溶液,此时溶液体积为(x+100)mL。代入式(4.16),解得x=65mL
配制方法:量取100mL0.10mol·L-1的HAc溶液后再量取65mL0.10mol·L-1的NaOH溶液,混合均匀就配成了pH=5.0的缓冲溶液。
