5.5.2 化学电源
5.5.2 化学电源
常见的化学电源有干电池、燃料电池及铅蓄电池,其中干电池包括锌锰干电池、锂电池和银锌电池等。
5.5.2.1 干电池
1.锌-锰干电池 锌-锰干电池结构如图5.10所示,电池的负极是外壳锌皮,正极是石墨棒。石墨棒的周围是由MnO2、乙炔炭黑及NH4Cl溶液混合压紧的团块,周围装入用NH4Cl溶液浸湿的ZnCl2和淀粉调制成的糊状物;为了避免水的蒸发,外壳用蜡和沥青封固。放电时其电极反应为:
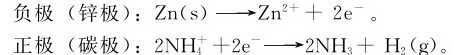
由于反应过程中碳极上将积集大量氢气泡,妨碍了碳极与 进一步的接触,使电池内阻增大,这叫电极的极化作用。因此,干电池中须加入MnO2作去极(化)剂,发生如下反应:
进一步的接触,使电池内阻增大,这叫电极的极化作用。因此,干电池中须加入MnO2作去极(化)剂,发生如下反应:
2MnO2(s)+H2(g)=2MnO(OH)(s)。
电池的正极反应为:

此干电池的电动势为1.5V。
2.锌-汞干电池 将电池中填充物换为HgO和KOH,又称为碱性电池。电池反应为:
Zn(s)+HgO(s)+H2O=Zn(OH)2(s)+Hg(l)
此电池电动势为1.35V。
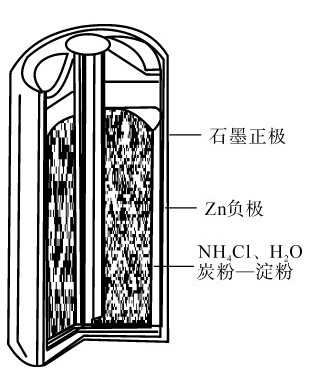
3.氧化银电池 氧化银电池是一种小型电池,结构如图5.11所示,正极为Ag2O,负极是Zn,反应在碱性介质中进行:
负极:Zn(s)+2OH-→Zn(OH)2(s)+2e-
正极:Ag2O(s)+H2O+2e-→2Ag(s)+2OH-
此电池电动势为1.5V。
5.5.2.2 蓄电池
蓄电池是一种可以积蓄电能的装置。放电后,用直流电源充电,可使电池恢复到原来的状态,能反复使用。
1.铅蓄电池 铅蓄电池用2组铅锑合金格板作电极。格板的孔穴一组填充二氧化铅,另一组填充海绵铅,以硫酸(密度1.2~1.3g·mL-1)为电解液,结构如图5.12所示。放电时,电极反应为:
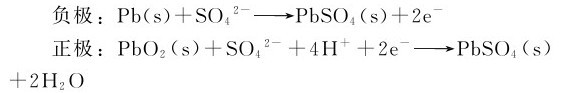
电池反应:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O
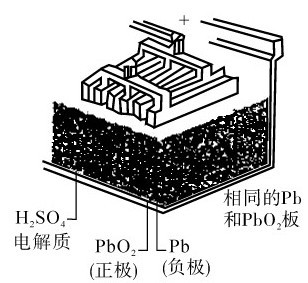
放电之后,正负极板上都沉积上一层PbSO4,所以铅蓄电池在使用到一定程度之后,就必须充电。充电时将一个电压略高于蓄电池电压的直流电源与蓄电池相接,将蓄电池负极上的PbSO4还原成Pb,而将蓄电池正极上的PbSO4氧化成PbO2,于是蓄电池电极又恢复原来状态,以供使用。充电时的电极反应:
铅蓄电池的充电过程恰好是放电过程的逆反应,即

此电池电动势为2.1V。
2.镍镉电池 镍镉电池是近年来用途广泛的一种蓄电池,负极为镉,正极为NiO2,在碱性电解质中的反应为:
负极反应:Cd(s)+2OH-→Cd(OH)2(s)+2e-
正极反应:NiO2(s)+2H2O+2e-→Ni(OH)2(s)+2OH-
放电反应:Cd(s)+NiO2(s)+2H2O=Cd(OH)2(s)+Ni(OH)2(s)
此电池电动势为1.4V。
3.锂-锰氧化物电池 正在研究之中。该电池中的Li+在锂-锰氧化物电极和碳电极之间移动,它提供的能量约为镍镉电池的3倍,提供的电压为3.7V,充电1000次仍能维持其放电容量的90%。这种高效、安全、便宜的电池可能取代铅蓄电池和镍-镉电池。心脏起搏器是现代科学的奇迹,所用电池的电极是金属锂,固体电解质是碘化锂。最好的锂-碘电池寿命超过10年,这对心脏病患者延续生命来说,堪称无价之宝。
4.锂离子电池 它是Li+嵌入化合物中为负极的可充电电池。正极采用锂化合物LixCoO2、LixNiO2或LiMnO4,负极采用锂-碳层间化合物Li6C6,电解质为溶解有锂盐LiPF6、LiAs6等的有机溶液。在充放电过程中,Li+在两个电极之间往返嵌入和脱嵌,被形象地称为“摇椅电池”。
目前已商品化的锂离子电池正极是LiCoO2,负极是层状石墨。电池反应为:
Li1-xCoO2+LixC6=LiCoO2+6C
锂离子电池工作电压高,一般为3.3~3.8V,体积小,比能量高,自放电小,循环寿命长,可达500~1000次,使用温度范围较宽,为-20~55℃。该电池设有安全装置,不仅使用安全,而且不会对环境造成污染,被称为绿色电池,被认为是21世纪应发展的理想能源。
5.5.2.3 燃料电池
由“燃料”(如氢气、烃、甲醇、煤气等)与氧化剂(如氧气、氯气、空气等)制成的电池称为燃料电池。其电极采用含有催化剂的多孔碳、多孔镍和铂等,电池的电解质用KOH溶液或固体电解质。
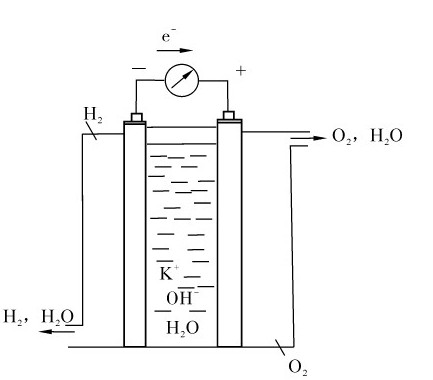
燃料电池种类很多,这里只介绍氢-氧燃料电池。这种电池的燃料为氢气,氧化剂为氧气,电极为多孔碳,负极含有铂或钯,正极含有钴、银或金的氧化物,电解质为KOH溶液,如图5.13所示。其电池符号为:
(-)C│H2(g)│KOH│O2(g)│C(+)
负极反应:2H2(g)+4OH-→4H2O+4e-。
正极反应:O2(g)+4e-+2H2O→4OH-
电池反应为:2H2(g)+O2(g)=2H2O
燃料气体都是共价分子,反应过程必须先离子化,此过程速率较慢,所以筛选催化剂是关键问题之一。燃料气体在进入装置前必须经预处理,除尽杂质,因此对大气污染比火力发电少得多。目前10~20kW的碱性H2-O2燃料电池已应用于阿波罗登月飞行和航天飞机,磷酸型CH4-O2燃料电池在美国已有50台,4.8mW的燃料电池发电站正在纽约和东京试运转。但由于电极催化剂成本太高,至今尚未能普遍使用,进一步提高其效率和可靠性是待研究的课题之一。
【人物简介】

1.伽伐尼(Luigi Gal-vani,1737—1798) 意大利医生和动物学家。1737年9月9日诞生于意大利的波洛尼亚。他从小接受正规教育,1756年进入波洛尼亚大学学习医学和哲学。1759年从医,开展解剖学研究,还在大学开设医学讲座。1766年任大学解剖学陈列室示教教师,1768年任讲师。1782年任波洛尼亚大学教授。1791年他把自己长期从事蛙腿痉挛的研究成果发表,这个新奇发现,引起科学界极大的震惊。
伽伐尼晚年在生活上和政治上连遭打击,贫病交加,1798年12月4日在波洛尼亚去世,终年61岁。
伽伐尼对物理学的贡献是发现了伽伐尼电流。

2.能斯特(Walther Hermann Nernst,1864—1941) 德国物理化学家,1864年6月25日生于西普鲁士的布利森。进入莱比锡大学后,在奥斯特瓦尔德的指导下学习和工作。1887年获博士学位。1891年任哥丁根大学物理化学教授。1905年任柏林大学物理化学教授。1925年起担任柏林大学实验物理研究所所长(1924—1933)。1932年被选为伦敦皇家学会会员。由于纳粹政权的迫害,1933年退职,在农村度过了他的晚年。1941年11月18日在柏林逝世。
能斯特是一位法官的儿子,他诞生的地点离哥白尼诞生地仅20英里。能斯特的早期工作是电化学,在这个领域里他作出了很多贡献。1889年作为一个25岁的青年在物理化学领域崭露头角,将热力学原理应用到了电池上。这是自伏特在将近一个世纪以前发明电池以来,第一次有人能对电池产生电动势作出合理解释。他推导出一个简单公式,即电化学中著名的能斯特方程。这个方程将电池的电动势同溶液浓度联系起来。能斯特的解释已为其他更好的解释所代替,但其方程沿用至今。1889年能斯特还引入溶度积这个重要概念,用来解释沉淀反应。他用量子理论的观点研究低温下固体的比热;提出光化学的“原子链式反应”理论。1903年,提出了缓冲溶液概念。
1906年,能斯特的主要工作是在热力学方面,根据对低温现象的研究,得出了热力学第三定律,人们称之为“能斯特热定理”,这个定理有效地解决了计算平衡常数问题和许多工业生产难题。由于他在热力学方面的工作,能斯特获得了1920年诺贝尔化学奖。此外,他还研制出含氧化锆及其他氧化物发光剂的白炽电灯;设计出用指示剂测定介电常数、离子水化度和酸碱度的方法;发展了分解和接触电势、钯电极性状和神经刺激理论。能斯特共发表157篇论文,著有14本书,最著名的为《理论化学》(1895)。
【阅读材料】
金属腐蚀及防护原理
腐蚀(corrosion)是指材料在其周围环境的作用下引起的破坏或变质现象。金属腐蚀定义:金属与周围环境(介质)之间发生化学或电化学作用而引起的破坏或变质。金属腐蚀发生在金属与介质间的界面上。由于金属与介质间发生化学或电化学反应,使金属转变为氧化(离子)状态。因此,金属及其所处环境构成的腐蚀体系及体系中发生的化学和电化学反应就是金属腐蚀学的主要研究对象。
金属腐蚀作为一门独立的学科,则是在20世纪初才逐渐形成的。
一、腐蚀的分类(按腐蚀机制分类)
1.化学腐蚀(chemical corrosion) 化学腐蚀是指金属与腐蚀介质直接发生反应,在反应过程中没有电流产生。金属原子直接与反应物(如氧)的分子相互作用,金属转变为离子状态的氧化反应和介质中氧化剂组分的还原反应是在同时、同一位置发生的。最重要的化学腐蚀形式是气体腐蚀,如金属的氧化过程或金属在高温下与SO2、水蒸气等的化学作用。
2.电化学腐蚀(electrochemical corrosion) 电化学腐蚀是指金属与电解质溶液(大多数为水溶液)发生了电化学反应而发生的腐蚀。其特点是:腐蚀过程中同时存在两个相对独立的反应过程——阳极反应和阴极反应,同时有电流产生。自然条件下,如潮湿大气、海水、土壤、地下水及化工、冶金生产中绝大多数介质中金属的腐蚀通常具有电化学性质。
3.物理腐蚀(physical corrosion) 物理腐蚀是指金属由于单纯的物理溶解作用引起的破坏。熔融金属中的腐蚀就是固态金属与熔融液态金属(如铅、钵、钠、汞等)相接触引起的金属溶解或开裂。这种腐蚀是由于物理溶解作用形成合金,或液态金属渗入晶界造成的。
4.生物腐蚀(biological corrosion) 生物腐蚀指金属表面在某些微生物生命活动产物的影响下所发生的腐蚀。微生物进行生命代谢活动时会产生各种化学物质,这种细菌代谢活动所产生的酸会造成水泵等机械设备的严重腐蚀。
二、析氢腐蚀与吸氧腐蚀
1.析氢腐蚀 以氢离子还原反应为阴极过程的腐蚀称为析氢腐蚀(hydrogen evolution corrosion)。发生析氢腐蚀的必要条件是,金属的电极电势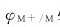 必须低于氢离子的还原反应电势。
必须低于氢离子的还原反应电势。
析氢电势等于氢的平衡电势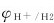 与析氢过电势η之差:
与析氢过电势η之差:
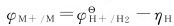
析氢过电势ηH与通过的阴极电流密度、阴极材料和溶液组成等因素有关。一种金属在给定的腐蚀介质中是否会发生析氢腐蚀,可以通过Nernst方程计算来判断。
析氢腐蚀多数为阴极控制或阴、阳极混合控制,腐蚀速度主要决定于析氢过电势的大小。因此,为了减小或防止析氢腐蚀,应设法减小阴极面积,提高析氢过电势。对于阳极钝化控制的析氢腐蚀,则应加强钝化,防止活化。
2.吸氧腐蚀 以氧的还原反应为阴极过程的腐蚀,称为氧还原腐蚀(oxygen reduction corrosion)或吸氧腐蚀(oxygen-consuming corrosion)。发生吸氧腐蚀的必要条件是金属的电势比氧还原反应的电势低,即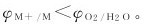 自然界中,溶液与大气相通,溶液中溶解有氧。在中性溶液中,氧的还原电势为0.805V。所以,许多金属在中性或碱性溶液中,在潮湿大气、淡水、海水、潮湿土壤中,都能发生吸氧腐蚀,甚至在酸性介质中也会有部分吸氧腐蚀。不难看出,与析氢腐蚀相比,吸氧腐蚀具有更普遍、更重要的意义。
自然界中,溶液与大气相通,溶液中溶解有氧。在中性溶液中,氧的还原电势为0.805V。所以,许多金属在中性或碱性溶液中,在潮湿大气、淡水、海水、潮湿土壤中,都能发生吸氧腐蚀,甚至在酸性介质中也会有部分吸氧腐蚀。不难看出,与析氢腐蚀相比,吸氧腐蚀具有更普遍、更重要的意义。
工业上使用的金属常常含有杂质,如在钢铁中,除铁以外还含有石墨、Fe3C等电极电势较高的杂质。当钢铁制件暴露于潮湿空气中,便形成了数目很多面积又很小的微电池。微电池是指两极肉眼不可见,并且两极密接的腐蚀电池。Fe为阳极,杂质为阴极,使Fe很快地遭到腐蚀。上述腐蚀又叫做微电池性腐蚀。
有些腐蚀电池的两极可以明显地观察到,即肉眼可见,称为宏电池,如铝板上铆一铜钉。金属构件表面有一层水膜,由于两种金属的电极电势不同形成的电池腐蚀,叫宏电池性腐蚀。在此宏电池中,电极反应如下:
阳极:Al→Al3++3e-
阴极:O2+2H2O+4e-→4OH-
总反应:4Al+3O2+6H2O=4Al(OH)3↓
三、金属腐蚀的防护
1.改善金属的防腐性能 尽可能地除去金属中的有害杂质,减少形成腐蚀电池的可能性,或增加一些能加大电极极化的成分以减小腐蚀速度,这些都能改善金属的防腐性能。例如在生铁中加入硅(Si)、钼(Mo)制成硅钼铸铁,它能耐酸的腐蚀。高硅铸铁除氢氟酸外,不受其他酸的腐蚀。
2.在金属表面覆盖各种保护层 这种方法的实质是使金属与外部介质隔绝,以阻止金属表面微电池的形成。这就要求保护层具有高度的连续性和致密性,保护层本身在使用介质中必须是稳定的,保护层与被保护的金属必须结合牢固。

3.电化学保护 电化学保护就是使金属构件极化到免蚀区或钝化区而得到保护。电化学保护分为阴极保护和阳极保护。
(1)阴极保护:阴极保护是使金属构件作为阴极,通过阴极极化来消除该金属表面的电化学不均匀性,达到保护目的。阴极保护可通过两种方法实现:一是牺牲阳极法,二是外加电流法。
1)牺牲阳极法:牺牲阳极法是在被保护的金属上连接电极电势更低的金属或合金,作为牺牲阳极,靠它不断溶解所产生的电流对被保护的金属进行阴极极化,达到保护的目的。牺牲阳极法包括牺牲阳极材料的确定和设计安装两大部分。
牺牲阳极材料必须能与被保护的金属构件之间形成足够大的电势差(一般在0.25V左右)。
常用的牺牲阳极材料有:Zn-0.6Al-0.1Cd,Al-2.5Zn-0.02In,Mg-6Al-3Zn-0.2Mn,高纯锌等,其中铝合金多用于海水中。
2)外加电流法:外加电流法是将被保护金属接到直流电源的负极,通以阴极电流,使金属极化到保护电势范围内,达到防蚀目的。
50年代后随着电子工业的发展,外加电流阴极保护技术得到很大发展。外加电流阴极保护系统具有体积及质量小、能自动调节电流和电压、运用范围广等优点,若采用可靠的不溶性阳极,其使用寿命较长。
(2)阳极保护:将被保护的金属设备与外加直流电源的正极相连,在腐蚀介质中使其阳极极化到稳定的钝化区,金属设备就得到保护,这种方法称为阳极保护法。
