5.3.2 判断氧化还原反应自发进行的方向
5.3.2 判断氧化还原反应自发进行的方向
任何两个电对,原则上都可以设计成原电池,利用所设计的原电池的电动势,可以判断氧化还原反应进行的方向。根据式(5.2),在等温、等压的条件下:
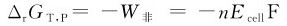
(1)ΔG<0时,E>0,氧化还原反应正向进行。
(2)ΔG=0时,E=0,氧化还原反应处于平衡状态。
(3)ΔG>0时,E<0,氧化还原反应逆向进行。
从原电池的电动势与氧化还原电对的电极电势之间的关系来看,只有φ正>φ负时,氧化还原反应才能自动向正反应方向进行。这就意味着,电极电势较大的电对为正极,发生还原反应;电极电势较小的电极为负极,发生氧化反应。因此,须利用能斯特方程计算出各氧化还原电对的电极电势,然后再进行比较。当氧化剂所在电对的电极电势大于还原剂所在电对的电极电势时,氧化还原反应自发进行,即以电极电势较大电对中的氧化型物质为氧化剂,以电极电势较小电对中的还原型物质为还原剂时,氧化还原反应自发进行。当各电对的标准电极电势相差较大(一般在0.2V以上)时,可以直接利用标准电极电势进行比较。在这种情况下,浓度的改变不会引起E值正负号的改变。根据电极电势表的排序,氧化还原反应按左下右上的对角线方向进行,如图5.4所示。
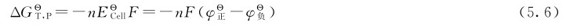

例5.4 解释在标准状态下,三氯化铁溶液为什么可以溶解铜板?

对于反应:2Fe3++Cu=2Fe2++Cu2+,电对Fe3+/Fe2+作电池的正极;电对Cu2+/Cu作电池的负极。
标态下: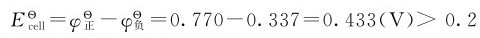 ,反应向右自发进行,所以三氯化铁溶液可以氧化铜板。
,反应向右自发进行,所以三氯化铁溶液可以氧化铜板。
例5.5 试判断电池反应: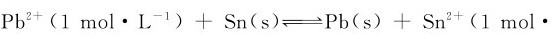 L-1)是否能正方向进行?若把Pb2+离子浓度减少到0.1mol·L-1,而Sn2+离子浓度仍维持在1mol·L-1,问反应是否能按上述正反应方向进行?
L-1)是否能正方向进行?若把Pb2+离子浓度减少到0.1mol·L-1,而Sn2+离子浓度仍维持在1mol·L-1,问反应是否能按上述正反应方向进行?
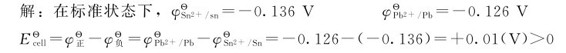
∴在标准状态下,反应能向正反应方向进行。
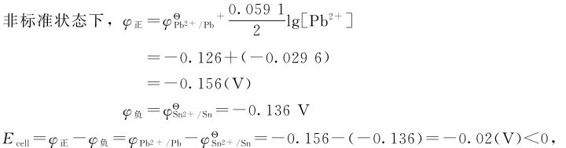
∴在此条件下,反应不能朝正反应方向进行。
