7.8.4 金属晶体
7.8.4 金属晶体
金属的通性是具有金属光泽,是热和电的良导体,并有一定的延展性。这些性质是由金属的内部结构所决定的。
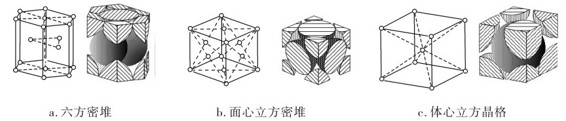
金属在形成晶体时,倾向于形成极为坚实紧密的结构,这已为金属的X射线研究所证实。要形成这样的结构,晶体中每个原子应有尽可能多的相邻原子,因此晶体中原子的配位数较高,一般是8或12。金属中最常见的有三种晶格,即六方密堆、面心立方密堆和体心立方晶格,如图7.30所示。其中前两种晶格中,原子都是以等半径的球体(原子)一个挨一个地紧密堆积,每个金属原子的配位数为12。而体心立方晶格的配位数为8,其堆积方式较前两种的坚实紧密程度要差。属于体心立方密堆的金属有K、Rb、Cs、Li、Na、Cr、Mo、W、α-Fe等,面心立方密堆的金属有Sr、Ca、Pb、Ag、Au、Al、Cu、Ni等,六方密堆的金属有La、Y、Mg、Zn、Hf、Cd、Ti和Co等。金属的密堆结构对其性质有重要影响。
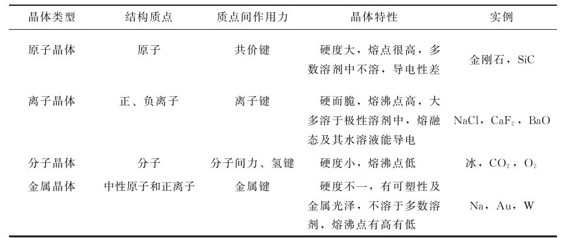
为了便于记忆和掌握上述四种类型晶体结构和性质的关系,现归纳列入表7.8。
表7.8 四种类型晶体的结构和特性
【人物简介】
1.鲍林(Linus Pauling,1901—1995) 美国化学家。1901年2月28日生于美国俄勒冈州的波特兰市。1922年在俄勒冈州立大学获得化学工程理学学士学位,1925年获得哲学博士学位。1926年成为哥根海姆基金会会员,并以会员身份在欧洲许多大学和当时一些著名科学家如薛定谔、玻尔等共同从事研究工作。1931年在美国俄勒冈州立大学任教授,并同时获得了美国化学会纯化学奖——兰缪尔奖。

鲍林在科学研究方面主要从事分子结构的研究,特别是化学键的类型及其与物质性质的关系。他提出的元素电负性标度、原子轨道杂化理论等概念,为每个化学工作者所熟悉。特别是鲍林所著的《化学键的本质》更是化学结构理论方面的经典著作。由于鲍林对化学键的研究以及用化学键的理论阐明复杂的物质结构,获得了1954年的诺贝尔化学奖。此外,鲍林在生物化学和医学方面也有很深的造诣,并取得了重要成果。鲍林共发表论文500余篇,著作10余部。他在科学研究和社会活动方面均有巨大贡献。为此,牛津大学等30多所世界著名大学授予他荣誉博士学位。意大利、印度等10多个国家的科学院授予他荣誉院士。苏联授予他罗蒙诺索夫金质奖章和列宁和平奖。在美国他也获得了10多项奖章。
鲍林不仅是一位杰出的化学家,而且是一位社会活动家。他在反对战争,促进世界和平方面也有突出贡献。1946年他应爱因斯坦的请求,发起成立了“原子科学家紧急委员会”。1955年与51名诺贝尔奖得主发表宣言,反对美、苏核试验。1962年他写信给美国总统肯尼迪和苏联领导人赫鲁晓夫,要求两国停止核试验,促使美、英、苏三国于1963年在莫斯科签署《部分禁止核试验条约》。诺贝尔奖评选委员会授予鲍林1962年诺贝尔和平奖,鲍林成为当时唯一一位单独两次获得诺贝尔奖的科学家。鲍林于1995年去世,享年94岁。
鲍林曾于1973年和1981年两次来我国访问讲学,受到我国广大科学工作者的热情欢迎。
2.德拜(Peter Debye,1884—1966) 荷兰物理化学家。1884年3月24日生于荷兰Maasticht。1910年在慕尼黑大学获得物理学博士学位。此后,曾在苏黎世大学、乌德勒支大学、格丁根大学和莱比锡大学讲授物理学。1935年,任伯林威廉皇家理论物理学研究所所长。德拜的第一项研究成果是关于偶极矩,提出了分子中原子的排列和原子间距的知识。1916年,他提出粉末状态物质能用X射线研究晶体结构,从而免除了首先要制备良好晶体这一步骤。1923年他取得了最重要的成就之一,他和E·休克尔将S·阿伦尼乌斯关于溶液中盐离解为带正、负电的原子(离子)的理论加以推广,证明不是部分电离,而是全部电离。他还与休克尔建立了阐述电解质溶液某种性质的数学表达式,即德拜-休克尔方程。德拜因对偶极矩、X射线和气体中光散射的研究成果而获得了1936年诺贝尔化学奖。

1940年德军入侵荷兰前两个月,德拜去美国纽约州伊萨卡,在康奈尔大学讲学,1946年后入美国籍。至1950年,作为化学系主任退休。德拜于1966年11月22日在纽约去世。享年82岁。
【阅读材料】
超分子化学
在自然科学中,化学是一门中心学科,随着科学技术的不断发展、高新技术的不断深入、学科间的相互渗透,诞生了一门新兴的边缘学科——超分子化学(supramolecular chemistry)。超分子化学是研究由两个以上的化学物质(分子、离子等)以分子间力高层次组装的化学,称为“超越分子概念的化学”,简称超分子化学。超分子化学涉及无机与配位化学、有机化学、高分子化学、生物化学和物理化学。
超分子化学可以定义为“分子之上的化学”。分子化学主要研究原子之间通过共价键(或离子键)形成的分子实体的结构与功能,而超分子化学则研究两个或多个分子通过分子间力结合而成的化学实体的结构与功能。
1987年诺贝尔化学奖被在超分子方面作出杰出贡献的Pedersen C J, CramD J和Lehn J M等三位科学家共同分享,此后超分子化学的研究得到了长足的发展。
1992年《超分子化学》的创刊凸显了超分子化学在化学中的重要地位。
1996年由LehnJM教授任总编,世界各国超分子化学家共同编著的鸿篇巨制——十一卷本的《超分子化学大全》(comprehensive supramolecular chemistry)的出版面世,进一步推动了超分子化学的发展。
超分子化学研究的内容主要包括:
(1)固态超分子化学,分为晶体工程、二维和三维的无机网络。
(2)生物有机体系和生物无机体系的超分子反应性及传输。
(3)分子识别,分子离子客体的受体和分子客体的受体。
(4)超分子化学中的物理方法。
(5)模板、自组装和自组织。
(6)超分子技术,分为分子器件及分子技术的应用等。
超分子化学是一门年轻的学科,它正在发生日新月异的变化。超分子体系的分子构筑及功能组装,由于其在基础研究和应用研究领域的重要性已引起了国内外科学界的广泛关注,尤其是开辟合成受体的分子识别和分子组装在生命、信息和材料等学科方面具有潜在的广阔应用前景。我国的化学工作者也积极开展这方面的研究工作,并且已进入了由分子到分子有序聚集体的高层次研究。
(袁亚莉,周德风.无机化学.武汉:华中科技大学出版社,2007.9)
【思考题】
1.区别下列各组概念
(1)范德华力和氢键;(2)离子键和共价键;
(3)共价键和配位键;(4)永久偶极和瞬间偶极;
(5)极性分子和非极性分子。
2.共价键理论主要分为哪两种?分别简述其基本要点。
3.简要说明σ键和π键的主要区别。双原子分子中能否有两个以上σ键?为什么?
4.如何理解离子键没有方向性和饱和性?
5.为什么电子自旋方式相反的两个氢原子相互靠近时可形成稳定的氢分子?
6.键能与键解离能有何不同?
7.为什么原子轨道杂化后,能提高其成键能力?
8.什么是分子轨道?什么是成键分子轨道?什么是反键分子轨道?
9.原子轨道线性组合成分子轨道时,为什么必须符合能量近似原则、对称性匹配原则和最大重叠原理?
10.下列说法是否正确,为什么?
(1)相同原子间的三键键能是单键键能的3倍。
(2)对于多原子分子来说,其化学键的键能就等于它的解离能。
(3)多原子分子中,键的极性越强,分子的极性也越强。
(4)氢化物分子间均能形成氢键。
11.O2具有顺磁性,N2具有反磁性,用分子轨道理论解释之。
12.简述形成离域π键的条件。
13.化学键的极性与分子的极性有何区别?
14.下列说法是否正确?说明原因。
(1)不存在离子性为100%的离子键。
(2)凡是中心原子采用sp3杂化轨道成键的分子,其空间构型必定是正四面体。
(3)非极性分子中一定不含极性键。
(4)直线形分子一定是非极性分子。
(5)诱导力仅存在于极性分子与非极性分子之间。
