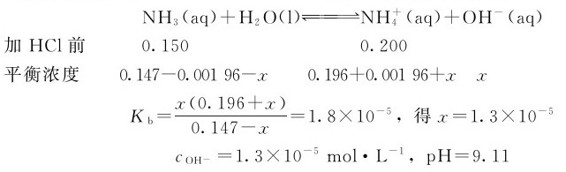4.4.2 缓冲溶液pH的计算
2025年09月17日
4.4.2 缓冲溶液pH的计算
在讨论缓冲溶液的缓冲原理时已经知道,缓冲溶液中的H+浓度取决于弱酸的解离常数和共轭酸、碱浓度的比值,即
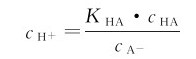
这一关系式实际上来源于弱酸HA的平衡组成的计算,与处理同离子效应的情况完全一样。如果将等式两边分别取负对数:
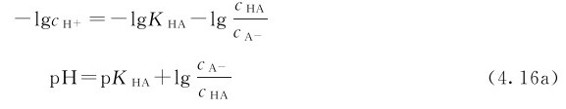
该式被称为亨德森Henderson-Hasselbalch方程。
对共轭酸碱对来说,25℃时pKa+pKb=14.00
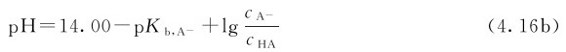
例4.6 若在50.00mL的0.150mol·L-1NH3(aq)和0.200mol·L-1NH4Cl缓冲溶液中加入1.00mL0.100mol·L-1的HCl溶液,计算加入HCl溶液前后溶液的pH各为多少?
解:加盐酸之前
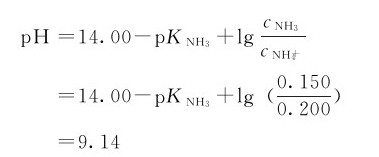
加入1.00mL0.100mol·L-1的HCl溶液之后,可认为这时溶液的体积为51.00mL,HCl、NH3与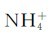 在该溶液中未反应前的浓度分别是:
在该溶液中未反应前的浓度分别是:
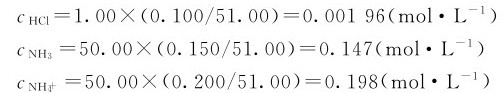
由于加入HCl,它全部解离产生的H+与缓冲溶液中的NH3反应生成了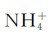 ,这样使NH3的浓度减少了0.00196mol·L-1,而
,这样使NH3的浓度减少了0.00196mol·L-1,而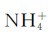 的浓度增加了0.00196mol·L-1。
的浓度增加了0.00196mol·L-1。