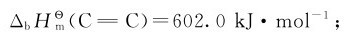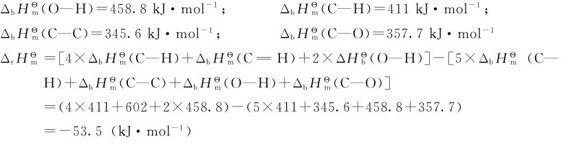2.2.3 赫斯定律
2.2.3 赫斯定律
1.赫斯定律(Hess’s law) 反应热一般可以通过实验测出,但是,有些复杂反应的某步反应若难以控制,该步反应的反应热就不易准确测定。例如,在恒温恒压下,碳燃烧生成CO2的反应可以按两种不同途径来完成:一种途径是碳燃烧直接生成CO2;另一种是碳先氧化成CO,CO再氧化成CO2。其中碳燃烧生成CO的反应热很难测定,因为碳不完全燃烧的产物中会混有少量的CO2。
约在1840年,俄国的科学家赫斯总结了大量热化学实验数据证明:任一个化学反应,不论是一步完成的,还是分几步完成的,只要始态、终态一定,其热效应都是一样的。这就是赫斯定律。
赫斯定律是一个经验定律,但在热力学第一定律建立后,这个定律就成为热力学第一定律的一个必然推论了。其完整表达为:任何一个化学反应在不做其他功和等压(或等容)的条件下,该反应不论是一步完成的,还是分几步完成的,其热效应的总值相等。
利用赫斯定律,上文的问题便可以解决。
例2.4 已知反应
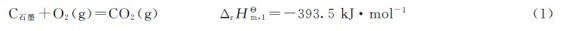
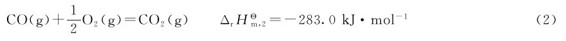
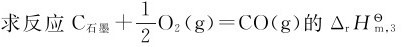
解:反应(2)的逆反应为
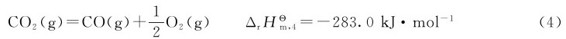
(1)+(4)得到:
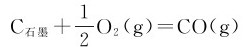
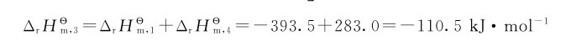
赫斯定律的实际意义:对很难直接测定反应热的化学反应,应用赫斯定律,则可以很方便地解决这一难题。
利用赫斯定律时应该注意以下三个方面的问题:
(1)反应热计算与方程式相对应。
(2)反应条件,即温度、压力必须相同。
(3)合并项物态必须相同。
2.由标准摩尔生成焓求反应热

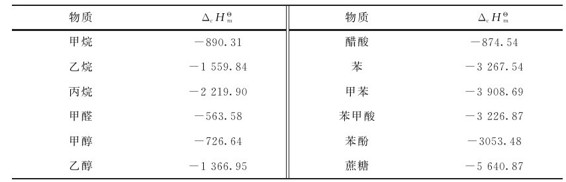
3.由标准燃烧热计算反应热 标准摩尔燃烧热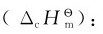 1mol物质在标准状态下完全燃烧,生成指定的稳定产物时的反应热,定义为该物质的标准摩尔燃烧热。部分有机化合物的标准摩尔燃烧热见表。
1mol物质在标准状态下完全燃烧,生成指定的稳定产物时的反应热,定义为该物质的标准摩尔燃烧热。部分有机化合物的标准摩尔燃烧热见表。
一般指定的稳定产物为:C→CO2(g),H→H2O(l),N→N2(g),Cl→HCl(aq)等。
表2.1 部分有机化合物的标准摩尔燃烧热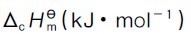
对于任意化学反应:αA+βB=γC+δD
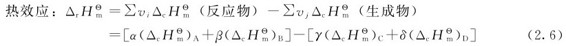
4.由键能估算反应热 在标准状态下,将1mol气体分子(AB)拆开,成为气体原子A和气体原子B所需要的能量为双原子分子的键能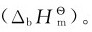 对于多原子分子,键能就是键的平均解离能。
对于多原子分子,键能就是键的平均解离能。
化学反应的实质是反应物分子中的化学键的断裂和生成物中的化学键的形成。断开化学键要吸热,形成化学键要放热,通过分析反应过程中化学键的生成和断裂可以计算出反应的生成热。
与燃烧热类似,化学反应热效应:
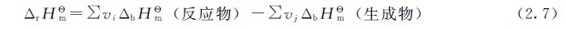
例2.6 计算乙烯与水作用生成乙醇的反应热。
解:化学反应为:
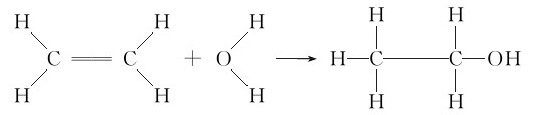
反应过程中断裂的键:4个C—H键;1个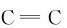 键;2个O—H键;
键;2个O—H键;
生成的键:5个C—H键;1个C—C键,1个C—O键,1个O—H键。
查表可知化学键的键能数据: