9.3.2 卤素单质
9.3.2 卤素单质
卤素单质为非极性分子,在水中的溶解度不大(氟与水激烈反应例外)。氯、溴、碘的水溶液分别称为氯水、溴水和碘水。卤素单质在非极性的有机溶剂中的溶解度比在水中的溶解度大得多。碘难溶于水,但易溶于碘化物溶液(如碘化钾)中,这主要是由于生成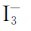 的缘故:
的缘故:
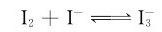
卤素单质最突出的化学性质是氧化性,F2是卤素单质中最强的氧化剂,随着X原子半径的增大,卤素的氧化能力依次减弱:
F2>Cl2>Br2>I2
1.卤素与单质的反应 卤素单质都能和H2直接化合生成卤化氢。F2与H2在阴冷处就能化合,放出大量热并引起爆炸。Cl2和H2的混合物在常温下缓慢化合,在强光照射时反应加快,甚至会发生爆炸反应。Br2和H2的化合反应比Cl2缓和。I2和H2则在较高的温度下反应。
氟能氧化所有金属及除氮、氧以外的非金属单质,一般总是把它们氧化到最高氧化态,而且反应非常激烈,常伴随着燃烧和爆炸。氟与铜、镍和镁作用时,由于生成金属氟化物保护膜,可阻止进一步被氧化,因此氟可以储存在铜、镍、镁或它们的合金制成的容器中。氯也能发生类似的反应,但反应比氟平稳得多。氯在干燥的情况下不与铁作用,因此可将氯储存于铁罐中。溴和碘在常温下可以和活泼金属直接作用,与其他金属的反应须在加热情况下进行。
2.卤素与水的反应 卤素与水可发生两类反应。
(1)卤素对水的氧化作用:
2X2+2H2O=4HX+O2↑
F2与水剧烈反应放出氧气,Cl2在日光下缓慢置换水中的氧,Br2与水非常缓慢地反应放出氧气,I2不能置换水中的氧,相反O2可氧化碘离子析出I2。
(2)卤素的水解作用,即卤素的歧化反应:
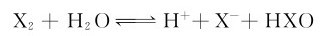
Cl2、Br2、I2与水主要发生第二类反应,此类歧化反应是可逆的,25℃时反应的平衡常数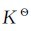 分别为4.2×10-4、7.2×10-9、2.0×10-13。可见,从Cl2到I2,反应进行程度越来越小。
分别为4.2×10-4、7.2×10-9、2.0×10-13。可见,从Cl2到I2,反应进行程度越来越小。
