6.6.2 电离能
6.6.2 电离能
元素的一个基态气态原子失去一个电子,变成一价气态正离子时所需的能量,称为该元素的第一电离能(ionization energy),用I1表示。从正一价离子再失去一个电子形成正二价离子时,所需要的能量叫做第二电离能,用I2表示,以此类推。同一元素各级电离能的大小有如下规律:I1<I2<I3<I4…原子失去一个电子形成正离子后,有效核电荷数Z*增加,半径r减小,故核对电子引力大,所以再失去第二个电子,第三个电子…更加不易。例如锂的第一电离能较小,为520kJ·mol-1,而其第二电离能增大了十几倍,为7298kJ·mol-1,这说明锂易于形成+1氧化态。铍的第一和第二电离能较低且接近,分别为900kJ·mol-1和1757kJ·mol-1,而第三电离能比第二电离能增加了数倍,为14849kJ·mol-1,这说明铍易形成+2氧化态。
元素的第一电离能最重要,I1是衡量元素的原子失去电子的能力和元素金属性的一种尺度。第一电离能越小,表示原子越易失去电子,即该元素金属性越强;反之,第一电离能越大,表示其原子越不易失去电子,即非金属性越强。元素的第一电离能的数据可由原子发射光谱实验得到,其数据见表6.6。
表6.6 元素的第一电离能I1(单位:kJ·mol-1)
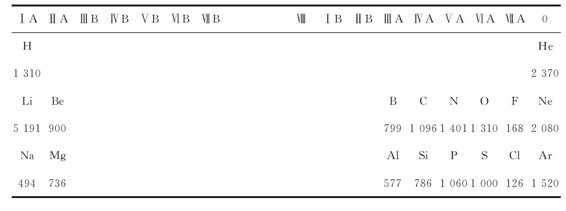
续表
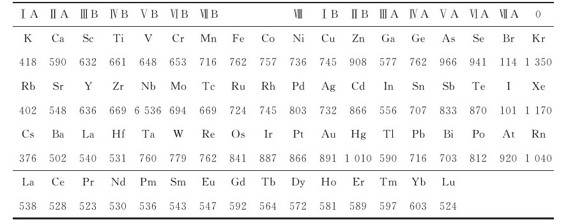
注:引自HuheeyJE, Inorganic Chemistry:Principles of Structure and Reactivity.2ndEd.和CRC, Handbook of Chemistry and Physics 73rdEd.(1992—1993)。
影响电离能大小的因素有原子半径、核电荷和电子层结构。在同一周期中,从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,原子越不易失去电子,所以电离能呈递增趋势,元素也从强金属性变化为强非金属性,到稀有气体达到最高的电离能。短周期主族元素的第一电离能从左向右增加的程度较大,原因是其原子半径减小的程度大。过渡元素的第一电离能从左向右增加的程度较小,原因是其原子半径减小的程度小。内过渡元素第一电离能增加的程度更小,且规律性不明显,因为它们新增加的电子是填入(n-1)d轨道或(n-2)f轨道,原子半径减小的程度小,且最外层电子构型基本相同。
这是一般规律,但也有反常现象出现,见图6.20。O和S的p电子失掉一个后,将得到较稳定的p轨道的半充满结构,所以这两种元素的第一电离能分别小于N和P,造成反常。对于B和Al,其电离能小于Be和Mg,原因类似。各周期中稀有气体的电离能最大,重要原因就是它们的原子具有稳定的8电子结构。
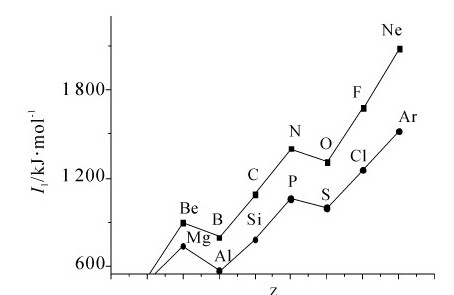
在同一主族中,从上向下一方面核电荷数增大,核对电子吸引力增大,将导致元素的第一电离能增大;另一方面,电子层数增加,原子半径增大,电子离核远,原子核和对外层电子引力减小,将导致元素的第一电离能减小。在这对矛盾中,以后者影响为主导。所以,同主族中自上而下,元素的电离能总的趋势是减小,金属性增强。
副族元素的电离能,第二过渡系列明显小于第三过渡系列,这是因为第二、第三过渡系列的原子半径相近,但第三过渡系列的核电荷数要比第二过渡系列大得多。
