7.7.2 分子的极性——偶极矩
2025年09月17日
7.7.2 分子的极性——偶极矩
由于形成分子的原子电负性不同,分子内出现正、负电荷重心不在同一点,这样的分子就具有极性。分子极性的大小,用偶极矩μ(dipole moments)来衡量。显然,偶极矩的大小与正电荷重心与负电荷重心之间的距离——偶极长(d),以及正负电荷重心的电量q有关。分子的偶极矩定义为分子的偶极长与偶极一端的电量的乘积,即μ=q·d。
偶极矩μ的大小反映了分子的极性:μ=0,为非极性分子(non-polar molecules);μ>0,为极性分子(polar molecules)。μ越大,分子的极性越强。如H2O的偶极矩是6.17×10-30C·m,HCl的偶极矩是3.57×10-30C·m,它们都是强极性分子。CO的偶极矩是0.40×10-30C·m,它是弱极性分子。
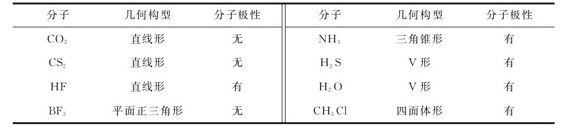
偶极矩μ还常被用来判断一个分子的空间结构。如NH3和BCl3都是四原子分子,这类分子的空间结构一般有两种:平面三角形和三角锥形。实验测得这两个分子的偶极矩分别为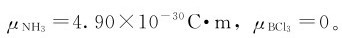 由此可以推测,在NH3分子中的N原子和3个H原子不在同一平面上,不会是平面三角形结构。而BCl3没有极性,4个原子可以处于同一个平面上。因此,NH3具有三角锥形结构,而BCl3分子是平面三角形结构。对双原子分子,分子的极性等同于化学键的极性。对多原子分子来说,分子的极性要视分子的组成与几何构型而定,如表7.5所示。由表7.5可见,结构对称(如直线形、平面正三角形、正四面体)的多原子分子,其分子为非极性分子;结构不对称(如V形、四面体、三角锥形)的多原子分子,其分子为极性分子。
由此可以推测,在NH3分子中的N原子和3个H原子不在同一平面上,不会是平面三角形结构。而BCl3没有极性,4个原子可以处于同一个平面上。因此,NH3具有三角锥形结构,而BCl3分子是平面三角形结构。对双原子分子,分子的极性等同于化学键的极性。对多原子分子来说,分子的极性要视分子的组成与几何构型而定,如表7.5所示。由表7.5可见,结构对称(如直线形、平面正三角形、正四面体)的多原子分子,其分子为非极性分子;结构不对称(如V形、四面体、三角锥形)的多原子分子,其分子为极性分子。
表7.5 分子的极性与几何构型的关系