9.4.2 臭氧
2025年09月17日
9.4.2 臭氧
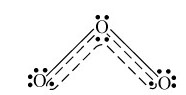
1.臭氧的分子结构 臭氧分子呈V形或角形,中心氧原子以sp2杂化态与其他两个端基氧原子相结合。键角为116.8°,键长为127.8pm(该键键长正好介于氧原子间的单键键长148pm与双键键长112pm之间)。中心氧原子未参与杂化的p轨道上有一对电子,端基氧原子的轨道上各有一个电子,这些未参与杂化的轨道互相平行,彼此重叠形成了垂直于分子平面的三中心四电子大π键,以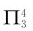 表示。这种大П键是不定域(或离域)π键,不固定在两个原子之间。臭氧分子中无单电子,故为反磁性物质。
表示。这种大П键是不定域(或离域)π键,不固定在两个原子之间。臭氧分子中无单电子,故为反磁性物质。
2.臭氧的性质和用途 臭氧是淡蓝色,有鱼腥臭味的气体,熔点80K,沸点161K。273K时,一升水可溶解490mL(是氧气溶解度的十倍)臭氧。
臭氧不稳定,在常温下分解较慢,但在437K时,将迅速分解,并放出大量热。
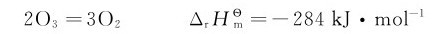
无论在酸性还是碱性条件下,臭氧都比氧气具有更强的氧化性,它能与除金和铂族金属外的所有金属和非金属反应:
PbS+2O3=PbSO4+O2
2Ag+2O3=Ag2O2+2O2
2KI+H2SO4+O3=I2+O2+H2O+K2SO4
最后这个反应可用于检验混合气体中是否含有臭氧。
