5.1.1 基本概念
5.1.1.1 氧化数
人们对氧化还原反应是逐步认识的。在18世纪末,人们把物质与氧结合称为氧化,而把含氧物质失去氧称之为还原。19世纪中叶,人们把化合价升高的过程称为氧化,而把化合价降低的过程称为还原。20世纪初,人们把失去电子的过程称为氧化,而把得电子的过程称为还原。由于共价化合物在反应中电子的得失不明显,氧化还原反应与非氧化还原反应的划分尚不明确。为了统一说明氧化还原反应,1970年,国际纯粹和应用化学联合会(IUPAC)定义了氧化数:氧化数(oxidation number)是指某元素一个原子的荷电数,这种荷电数由假设把每个化学键中的电子指定给电负性较大的原子而求得。
1.确定氧化数的规则
(1)在单质中,元素的氧化数为零,如P4、S8、Cl2中P、S、Cl的氧化数都为零。
(2)在正常氧化物中,O的氧化数为-2;在过氧化物(如H2O2,Na2O2)中,为-1;在超氧化物(如KO2)中,为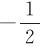 ;在OF2中,为+2。
;在OF2中,为+2。
(3)在一般化合物中,H的氧化数为+1;在金属氢化物(如CaH2,NaH)中,为-1。
(4)在单原子离子中,元素的氧化数等于离子的电荷数;在多原子离子中,各元素的氧化数代数和等于离子的电荷数。
(5)在中性分子中,各元素的氧化数的代数和等于零。
利用以上规则,就可以求出各种化合物中不同元素的氧化数。
2.氧化数与化合价(化学键)的区别
(1)含义不同:化合价是原子间相互作用力的表示,反映出形成化学键的能力;氧化数是人为规定的,服从公认的规则。例如C原子在有机化合物中的化合价都呈4价,而在不同化合物中,碳可以有不同氧化数,见表5.1。
表5.1 C原子在不同化合物中的化合价与氧化数
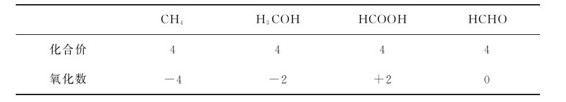
(2)数字范围不同:化合价取整数(一般为-4~+8),如Fe3O4,Fe的化合价为+2、+3。氧化数可以取零,分数和整数,如Fe3O4的表观(平均)氧化数为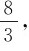 而实际氧化数为+2、+3。
而实际氧化数为+2、+3。
(3)符号不同:鲍林建议,氧化数表示为+m、-n;在离子化合物中,化合价用m+、n-表示,在共价化合物中,化合价用罗马字母表示,Fe(Ⅱ)、Fe(Ⅲ)。
5.1.1.2 氧化剂和还原剂
在氧化还原反应中,元素的氧化数升高的过程称为氧化;元素的氧化数降低的过程称为还原。氧化过程和还原过程总是同时发生的。
组成元素的氧化数升高的物质称为还原剂(reductant),它的反应产物称为氧化产物;组成元素的氧化数降低的物质称为氧化剂(oxidant),它的反应产物称为还原产物。例如,氧化还原反应:
10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O
KMnO4中的Mn的氧化数从+7降低到+2,发生还原反应,因此KMnO4是氧化剂;而FeSO4中的Fe的氧化数从+2升高到+3,发生氧化反应,因此FeSO4是还原剂。H2SO4虽然也参加了反应,但组成元素的氧化数没有改变,称为反应介质。
5.1.1.3 氧化还原电对
任何氧化还原反应都是由两个半反应组成的,一个是氧化剂被还原的半反应;另一个是还原剂被氧化的半反应。例如,氧化还原反应:
Cu2++Zn=Cu+Zn2+
是由两个半反应组成的:Cu2++2e→Cu 还原反应
Zn→Zn2++2e 氧化反应
氧化剂与它的还原产物及还原剂与它的氧化产物组成一个氧化还原电对(redox couple),简称为电对。在氧化还原电对中,组成元素的氧化数较高的物质称为氧化型物质,用符号Ox表示;组成元素的氧化数较低的物质称为还原型物质,用符号Red表示。书写氧化还原电对时,氧化型物质写在左侧,还原型物质写在右侧,中间用斜线“/”隔开,即写成Ox/Red。例如,上述两个半反应分别可以用Zn2+/Zn,Cu2+/Cu表示。
在氧化还原电对中,氧化型物质与还原型物质之间存在下列转化关系:
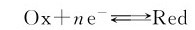
这种关系与质子酸碱中共轭酸碱对的关系相似。氧化型物质的氧化能力越强,其对应的还原型物质的还原能力就越弱;氧化型物质的氧化能力越弱,其对应的还原型物质的还原能力就越强。
