一、急性毒理试验
(一)研究目的
采用小鼠以最大给药量法,急性经口灌胃给予受试物,观察可能引起的毒性反应的性质、程度、时效关系及可逆性;推测毒性靶器官或靶组织;为重复给药毒性试验剂量设计、毒性反应监测指标选择,以及须重点观测的可能靶器官等提供参考和依据。
(二)试验材料
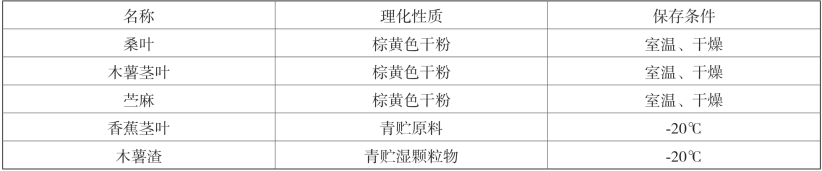
1.受试物:5种新资源饲料样品(见表2-1)
表2-1 受试物信息
2.溶媒(阴性对照)
名称:1%羧甲基纤维素钠水溶液。
含量(浓度):1%羧甲基纤维素钠。
理化性质及生物特性:无色澄明液体。
保存条件:密闭室温保存。
生产单位:自制。
溶媒配制原料:见表2-2。
表2-2 溶媒配制原料信息

3.实验动物
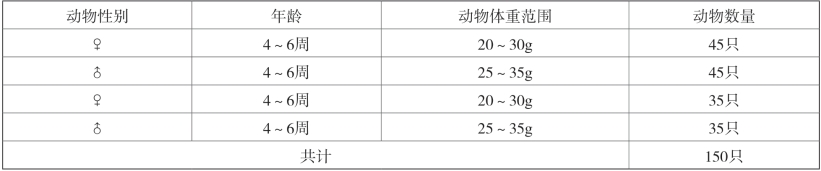
名称:昆明种小鼠(见表2-3)。
来源:昆明医科大学实验动物中心。
许可证号:SCXK(滇)K2015-0002。
发证单位:昆明市科学技术局。
表2-3 动物情况一览表
4.环境条件及饲养管理
(1)环境条件
普通环境动物实验室:温度:20~26℃;湿度:40%~70%。
(2) 饲养管理
①动物饲养笼具:透明CP小鼠饲养笼,20cm×10cm×10cm(长×宽×高), 配套不锈钢笼盖。
②饲料:SPF大小鼠生长繁殖饲料,北京科澳协力饲料有限公司,生产许可证号:SCXK(京)2012-0019。批号:16103125、17032123。
③饮水:实验过程中动物不限饮水,饮用水为净化后的自来水。
④垫料:灭菌玉米芯垫料。
⑤饲养:10只/笼,雌雄分开。垫料每周更换2次,更换笼具洗刷消毒。
(三)试验内容
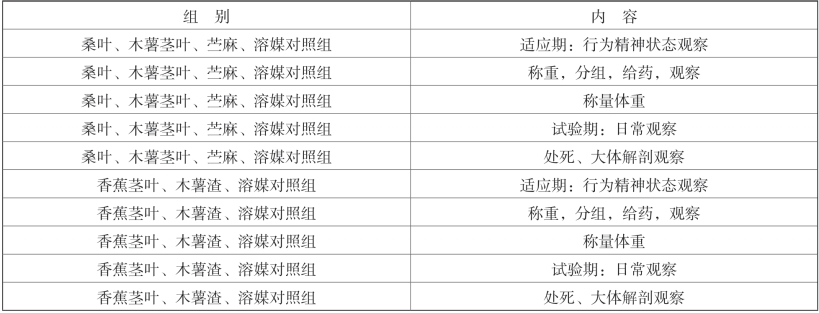
具体日程见表2-4。
表2-4 试验内容
(四)试验方法
1.动物接收及适应性饲养
动物接收后于中国科学院昆明动物研究所药物安全评价中心普通环境动物实验室进行适应性饲养。适应性饲养期间每日观察动物行为、精神、皮毛、眼、耳、口、鼻、外生殖器、四肢、尾等进行观察,适应期结束后称重淘汰体重过大/过小动物,选定方案预定数量动物进入正式试验。
2.动物禁食
给药前动物禁食不禁水14~18h。(https://www.daowen.com)
3.动物分组
适应性饲养结束后,用Excel随机分组法将动物相应组别,20只/组,雌雄各半。第一批动物分为4组,即桑叶、木薯茎叶、苎麻和对照组;第二批动物分为3组,即香蕉茎叶、木薯渣和对照组。
4.动物识别方法
动物标识:10只/笼饲养,雌雄分开,每笼动物用苦味酸标记编号为1~10号,小鼠盒悬挂笼卡以区分各实验组及性别等信息。
5.给药程序
①给药途径及频率:经口灌胃,24h内给药3次,每次间隔6~8h。
②剂量设计依据: 5种受试物均为新资源饲料样品,理论上应为微毒或无毒。前期预测实验结果:5种受试物按最大可配制浓度配制后,按小鼠最大灌胃容积(40mL/kg)经口灌胃(每个受试物4只动物,雌雄各半),24h内给药3次后,72h内未出现任何动物死亡。根据上述依据和预实验结果,本试验以最大给药量法,对各实验组给予最大给药剂量,观察各受试物的毒性反应情况。
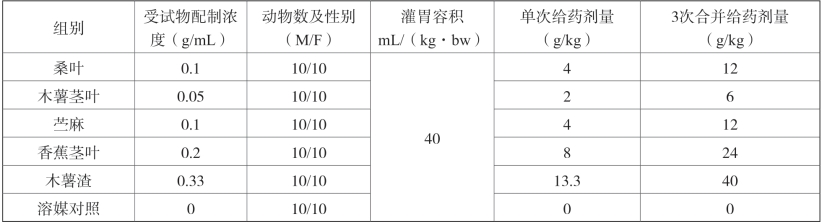
③给药剂量及容积:见表2-5。
表2-5 各实验组剂量列表
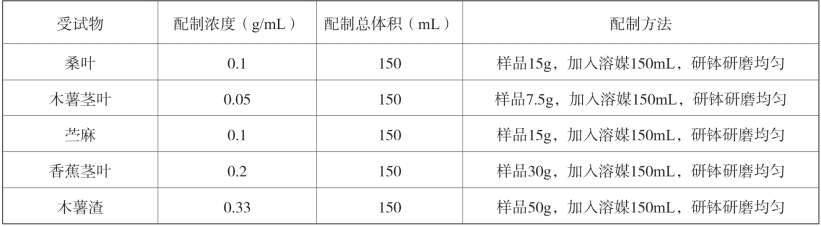
6.受试物配制及保存
①溶媒配制及保存:每100mL超纯水加入1g羧甲基纤维素钠,加热煮沸并持续搅拌直至羧甲基纤维素钠完全溶解成为澄明液体,转移至容量瓶用超纯水定容至初始体积;室温密封保存备用。
②受试物配制及保存:按表2-6进行,配制浓度均为各受试样品最大可配制浓度。于给药前一天配制后置于4℃冰箱备用,给药间歇期亦放置于4℃冰箱。
表2-6 受试物配制方法
7.日常观测指标
按试验方案每日进行行为观察并记录。灌胃后4、7、11、14d各称量一次并记录。
8.解剖观察
在试验期限内如动物出现死亡,应立即进行解剖观察,初步确定死亡原因;试验结束后对未死亡动物处死后,对各主要脏器进行大体解剖观察,如组织器官出现体积、颜色、质地等改变时,进行组织病理学检查。
(五)数据分析及统计方法
1.病死率和毒性症状
根据每日行为观察记录计算病死率;对出现毒性反应症状的动物描述其症状出现、持续及恢复时间。
2.解剖观察及组织病理学检查
如大体解剖观察发现病变组织器官并进行组织病理学检查后,描述出现病变的组织器官情况并计算其发生率。
3.体重数据
用SPASS 17.0软件进行单因素方差分析,方差齐用LSD分析,方差不齐用非参数检验。比较各受试物实验组与溶媒对照组在各称重日动物体重是否存在差异,统计结果以 \* MERGEFORMAT±SD表示,检验水准α=0.05。
\* MERGEFORMAT±SD表示,检验水准α=0.05。
(六)结果与分析
1.一般行为观察
每次给药后立即观察动物可能出现的不良反应症状和体征,当天连续观察至第三次给药后4h,以后每天观察一次。各受试物给药组动物均在每次给药后有不同程度地蜷缩、活动减少情况,30~60min后陆续恢复正常,上述症状与受试物按照最大给药量设计给药有关,因各受试物均达到最大配制浓度,均为较黏稠状混悬液,且灌胃给药容积为40mL/(kg·bw)(已达到小鼠最大灌胃容积),灌胃后在短时间内达到极限胃容量,可以判定上述症状非受试物毒性反应;灌胃后每日行为观察至14d,各实验组动物均未发现任何异常情况。
2.死亡情况
各实验组动物在试验期内均未出现死亡。
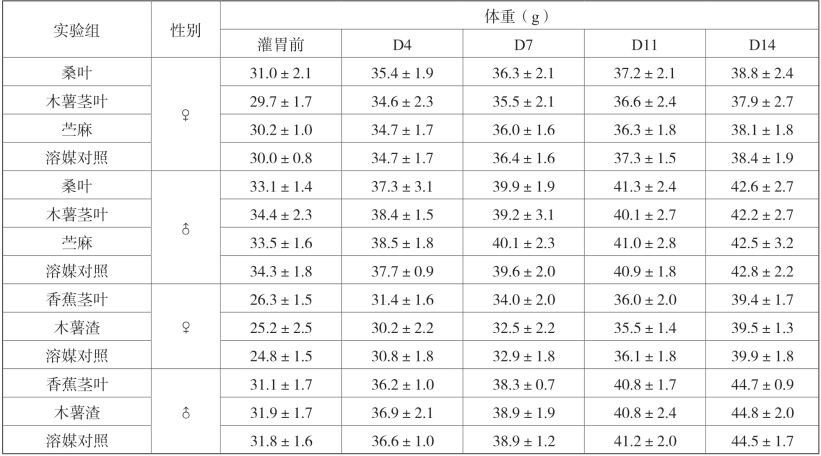
3.体重
各实验组动物在灌胃前及灌胃后4、7、11、14d各称重1次。各组动物体重均呈逐步增长趋势,未发现体重降低情况。各称重日各受试物给药组动物体重与溶媒对照组相比无显著性差异 (P>0.05)。
表2-7 各实验组动物体重
4.解剖观察
给药后14d,各实验组动物均未出现死亡,处死解剖对动物主要脏器:心脏、肝脏、脾脏、肺、肾脏、胃、肠、气管进行肉眼观察,未见异常。
(七)评价与结论
本试验条件下,采用最大给药量法对5种受试物进行单次给药毒性试验,在试验期限内各受试物给药组和溶媒对照组均未出现动物死亡;灌胃后日常观察未见异常毒性反应;各实验组动物体重均呈逐步增长趋势,给药组与溶媒对照组相比各称重日体重数据无显著性差异(P>0.05);试验期结束后对各实验组动物进行大体解剖观察,主要脏器未见异常。
结论:在本试验条件下5种受试物的最大给药量分别为:桑叶[12g/(kg·bw)]、木薯茎叶[6g/(kg·bw)]、苎麻[12g/(kg·bw)]、香蕉茎叶[24g/(kg·bw)]、木薯渣[40g/(kg·bw)],在各自给药剂量下未出现动物死亡和异常毒性反应情况。各受试物最大给药量均已大于5g/(kg·bw),可判定5种受试物均为实际无毒物质。
