二、长期毒性试验
(一)研究目的
采用SD大鼠经口灌胃给予受试物28d,恢复14d。在急性毒性试验基础上,进一步观察受试物引起的毒性作用性质、剂量—反应关系、可能的靶器官以及毒性反应的可逆性;判定最大未观察到有害作用剂量(NOAEL),初步评价受试物的安全性。
(二)试验材料
1.受试物
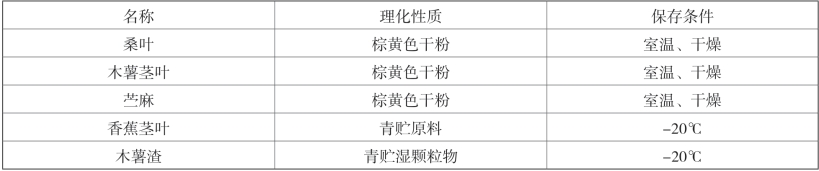
5种新资源饲料样品,见表2-8。
表2-8 受试物信息
2.溶媒
名称:1%羧甲基纤维素钠水溶液。
含量(浓度):1%羧甲基纤维素钠。
理化性质及生物特性:无色澄明液体。
保存条件:密闭室温保存。
生产单位:自制。
溶媒配制原料:见表2-9。
表2-9 溶媒配制原料信息
3.实验动物
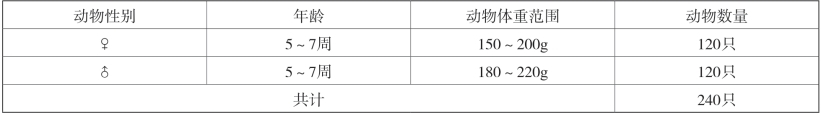
名称:SD大鼠(见表2-10)。
来源:昆明医科大学实验动物中心。
许可证号:SCXK(滇)K2015-0002。
发证单位:昆明市科学技术局。
表2-10 动物情况一览表
4.环境条件及饲养管理
(1)环境条件:普通环境动物实验室
温度:20~26℃;湿度:40%~70%。
(2)饲养管理
①动物饲养:透明CP大鼠饲养笼,40.5cm×25cm×20cm(长×宽×高), 配套不锈钢笼盖。
②饲料:SPF大小鼠生长繁殖饲料,北京科澳协力饲料有限公司,生产许可证号:SCXK(京)2012—0019。
③饮水:实验过程中动物不限饮水,饮用水为净化自来水。
④ 垫料:灭菌玉米芯垫料。
⑤饲养:10只/笼,雌雄分开。垫料每周更换2次,更换笼具洗刷消毒。
5.仪器设备(见表2-11)
表2-11 仪器设备一栏表
(三)试验周期及日程
动物适应期3~7d;灌胃期28d;恢复期14d。具体日程见表2-12。
表2-12 试验日程

(四)试验方法
1.动物接收及适应性饲养
接收动物时,仔细检查动物运输盒外包装是否完好和符合相应级别动物的包装要求,不合格及时通知供货方,退货;对所有动物进行性别区分,仔细观察动物的状况,合格者移至鼠盒中,不合格者作退货处理。挂笼卡标识,注明:项目编号、笼号、体重范围、性别,适应性饲养期限。适应性饲养至少3d,期间,对动物行为、精神、皮毛、眼、耳、口、鼻、外生殖器、四肢、尾等进行观察。若观察无明显异常,即可结束检疫和适应性饲养,进入试验阶段;发现异常动物,分析原因,据情况或淘汰或退货。
2.动物分组
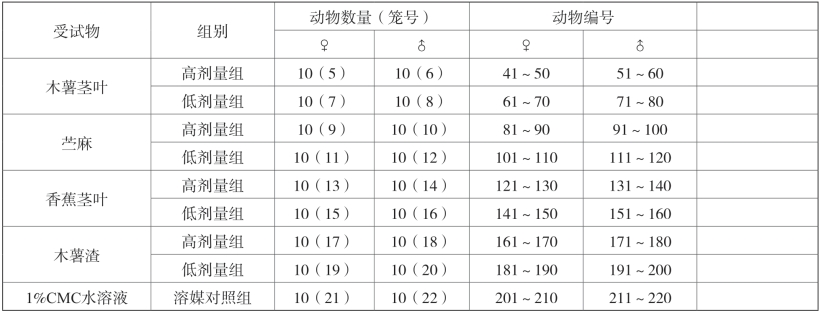
合格动物适应性饲养后称量体重,按体重分段,淘汰过大过小动物,选择体重均一、皮毛光泽、行为活动自如,一般状况良好的健康动物220只用于试验(雌雄各半)。每性别动物按体重分段后EXCEL随机数字法分为11组,10只/组。10只/笼饲养,雌雄分开。每个受试物设高、低2个剂量组,每组20只动物(雌雄各半),另设一个对照组(5个受试样品共用)。
3.动物识别方法
每笼动物用苦味酸标记其动物编号的个位数:1~9(个位数为0号的动物空白不做苦味酸标记),同时用记号笔在其尾部标记其动物编号;鼠盒悬挂笼卡以区分各试验组,注明:项目编号、组别、性别、笼号、动物编号范围、试验起止日期(表2-13)。
表2-13 动物分组及编号
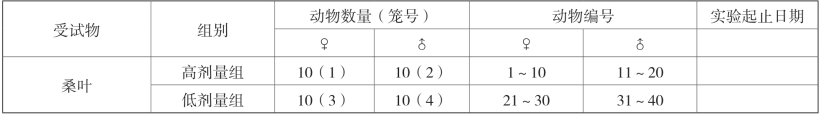
续表2-13
4.剂量设计及依据
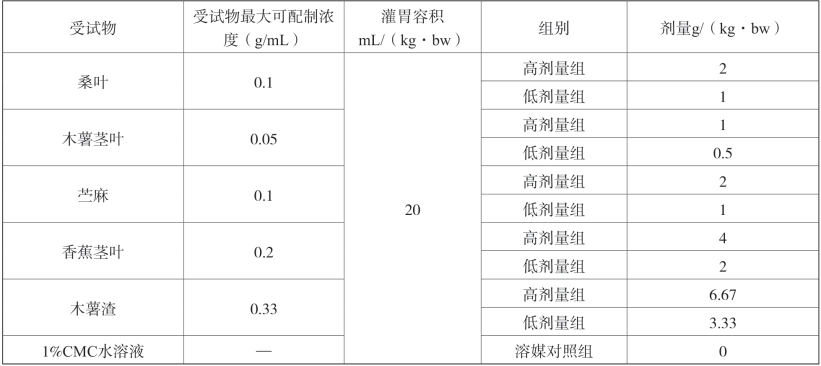
前期的急性毒性试验结果:5个受试物在给药容积为40mL/kg·bw条件下,3次经口灌胃合并最大给药量分别为:12g/(kg·bw)(桑叶)、6g/(kg·bw)(木薯茎叶)、12g/(kg·bw)(苎麻)、24g/(kg·bw)(香蕉茎叶)、40g/(kg·bw)(木薯渣),14d观察期内未见毒性反应及出现动物死亡情况,可判定三个受试物为实际无毒物质。为最大限量暴露和评价受试物的长期毒性,本试验以单次灌胃最大给药量(受试物最大可配制浓度与灌胃容积的乘积)为高剂量组,向下减半设一个低剂量组,具体剂量设置见表2-14。
表2-14 剂量设置
5.给药方法
①途径:经口灌胃,各剂量组均按相同灌胃容积给予不同浓度受试物混悬液,对照组给予相同灌胃容积的溶媒(1%CMC水溶液)。
②灌胃容积:20mL/(kg·bw)。
(3)给药频率:1次/d。
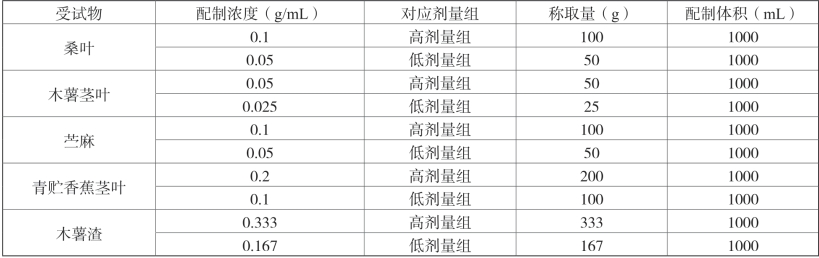
6.受试样品配制及保存(表2-15)
(1)溶媒配制及保存
每1000mL超纯水加入10g羧甲基纤维素钠,加热煮沸并持续搅拌直至羧甲基纤维素钠完全溶解成为澄明液体,转移至容量瓶用超纯水定容至初始体积;室温密封保存备用。
(2) 受试物样品配制
①桑叶、木薯茎叶、苎麻:为干粉状样品,按所需配制浓度及配制总体积,计算称量所需受试物量,置于研钵,加入适量溶媒研磨均匀后,转入适当容积容量瓶,用溶媒清洗研钵2~3次并转入容量瓶,最后定容。定容后采用搅拌、超声等方式混匀样品。受试物样品每次配制后最长使用4d,每次使用前须震荡混匀,抽吸样品过程中,每隔5min摇匀一次。
②香蕉茎叶:为香蕉茎叶青储发酵物,为茎叶原型物。取样品100g,精确量取500mL溶媒加入,置于搅拌机,30000转/min打碎搅拌10min,原液直接作为高剂量组灌胃样品;取50g样品经上述过程打碎搅拌后作为低剂量灌胃样品。
③木薯渣:为湿状颗粒物,取样品100g,精确量取300mL溶媒加入,置于搅拌机,30000转/min打碎搅拌10min,原液直接作为高剂量组灌胃样品;取50g样品经上述过程打碎搅拌后作为低剂量灌胃样品。
表2-15 受试物样品配制表
7.观测指标及频率(表2-16)
表2-16 实验期间检测指标及频率
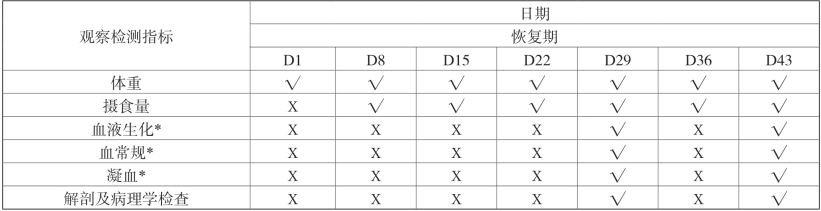
注:D1为给药第1d,D4为首次给药第4d,以此类推; “√”表示进行相关检测,“Х” 表示不进行相关检测;*项目:采集检测血样前禁食、禁水12~14h
(1)一般症状观察
每天观察动物外观、行为、分泌物、排泄物、死亡情况及中毒反应症状及其起始时间、严重程度、持续时间、是否可逆及恢复时间等,记录在相应的观察记录中。
(2)摄食量
每周测量1次摄食量,按每笼动物计算。摄食量=投放量-剩余量。
(3)体重称量
每周称量1次。
(4)血液生化
①检测时间:灌胃期结束(D29)、恢复期结束(D43)。
②采血方法:采样前待检测大鼠禁食至少12h,经股动脉采血约3.0mL。
③血样处理方法:血液样品(不抗凝)常温3000rpm(离心力约1800g)离心10min,分离血清进行检测。
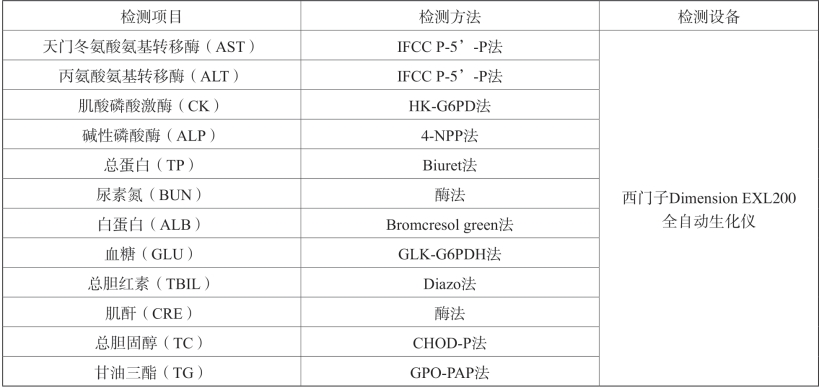
④检测指标:见表2-17。
表2-17 血液生化检测项目
(5)血液学
①检测时间:灌胃期结束(D29)、恢复期结束(D43)。
②采血方法:采样前待检测大鼠禁食至少12h,经股动脉采血约1.0mL。
③血样处理方法:以EDTA为抗凝剂,加入血液样本混匀后直接进样检测。
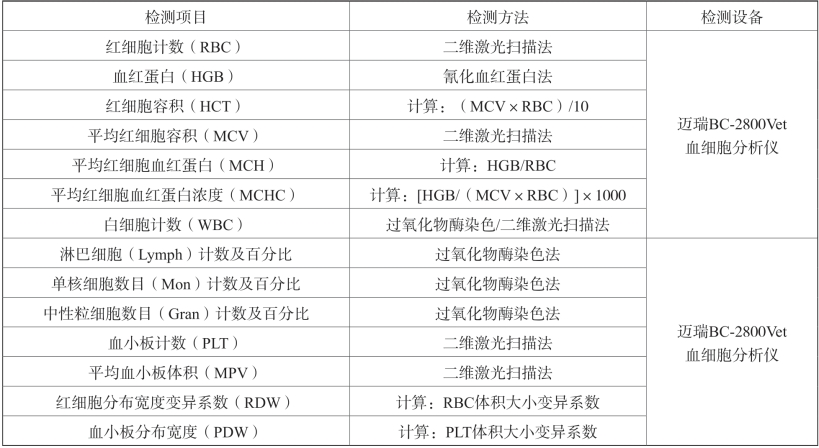
④检测指标:见表2-18。
表2-18 血液学检测项目
(6)凝血
①检测时间:灌胃期结束(D29)、恢复期结束(D43)。
②采血方法:采样前待检测大鼠禁食至少12h,经股动脉采血约2.0mL。
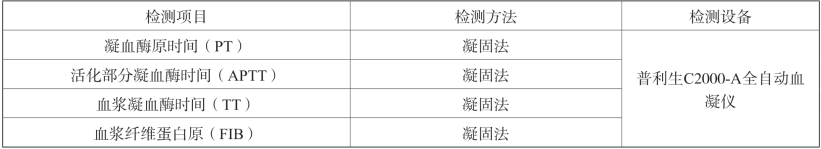
③血样处理方法:以枸橼酸钠抗凝为抗凝剂,加入血液样本混匀后,常温3000rpm(离心力约1800g)离心10min,分离血浆进行检测。④检测指标:见表2-19。
表2-19 凝血检测项目
8.解剖及脏器系数计算
(1)解剖
试验期结束(D29),各试验组约2/3动物(每组14只,雌雄各7只)处死解剖;恢复期结束(D43),各试验组剩余动物(每组6只,雌雄各3只)处死解剖。
(2)脏器系数
解剖前核对动物编号,检查动物外观并记录,摘取以下组织或器官称重并计算脏器系数:心脏、肝脏、肾脏、肾上腺、胸腺、脾脏、睾丸(雄性)、附睾(雄性)、卵巢(雌性)、子宫(雌性)、肺。脏器系数(%)=脏器重量/动物体重×100。
9.组织病理学检查
解剖时先对各主要脏器进行大体解剖观察并记录可见病变。按以下要求对各受试物高剂量组和对照组动物进行组织病理学检查,如高剂量组动物检查发现明显的组织病理学病变或异常,再对摘取保存的低剂量组动物进行相关组织或器官的病理学检查。
(1)检查的组织或器官
心脏、肝脏、脾脏、肺、肾脏、胃、肠。
(2)固定方法
以上组织或器官摘取后置于10%中性福尔马林固定液中固定1周以上。
(3)制片及染色
对各组上述组织按组织病理学技术标准操作进行取材、石蜡包埋、切片及苏木精-伊红染色后,进行显微镜检,对观察到病变进行半定量分级,由病理室出具病理报告。
(五)数据分析及统计方法
1.一般症状、体征观察
根据每日观察原始记录计算分析出现各特定异常症状的动物数。
2.解剖观察及组织病理学检查
解剖观察发现病变组织器官并进行组织病理学检查后,描述出现病变的组织器官情况并计算其发生率。
3.计量资料指标(https://www.daowen.com)
每次检测终点的原始数据都制成表格,以平均值和标准差表示。每一受试物高、低剂量组与溶媒对照组进行组间比较(表2-20)。
表2-20 高、低剂量组与溶媒对照组组间比较
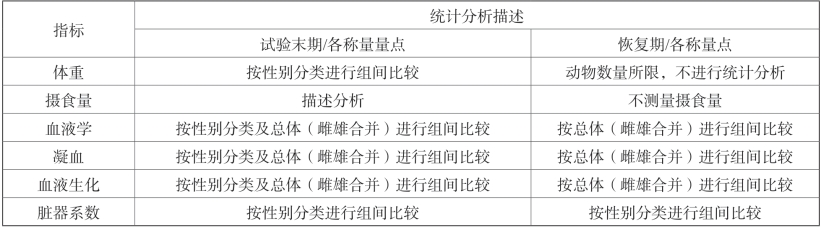
4.统计方法
用SPSS17.0 for Windows统计软件包进行数据处理分析。各组数据首先进行One-Sample Kolmogorov-Smirnov Test检验,如数据符合正态分布(P≥0.05),采用参数检验法进行分析;如数据不符合正态分布(P<0.05),则采用非参数检验法进行分析。参数检验法:采用单因素方差分析(ANOVA),LEVENE方差齐性检验提示方差齐选用LSD方法,方差不齐以Dunnett’s T3进行检验。非参数检验法:对不符合正态分布(P<0.05)数据采用Mann-Whitney U秩和检验(M-W法)进行分析。所有检验均为双侧检验,α=0.05。
(六)结果与分析
1.一般行为状况
灌胃期及恢复期,5种受试物各剂量组及溶媒对照组大鼠未见死亡,一般状况良好,自主活动正常,皮肤被毛清洁,未见毒性症状出现。
2.体重
(1) 桑叶试验组
雌性动物:灌胃第8d高剂量组与溶媒对照、低剂量组有显著差异(P=0.000),高剂量组动物体重明显降低;灌胃第15d高剂量组与溶媒对照组有显著差异(P=0.036),高剂量组动物体重偏低;灌胃第22d高剂量组与溶媒对照组有显著差异(P=0.030),高剂量组动物体重偏低;灌胃第28d高、低剂量组与溶媒对照组无显著差异。
雄性动物:灌胃第22d高剂量组(P=0.003)、低剂量组(P=0.032)与溶媒对照组相比均有显著差异,体重降低;灌胃第28d高剂量组与溶媒对照组相比有显著差异(P=0.019),体重降低。
小结:受试物桑叶对动物体重降低影响明显,但随着灌胃时间延续,该影响逐步消除;雌性动物自灌胃第8d出现体重降低情况,随后差异逐步减小,至灌胃第28d各剂量组体重均数无差异;雄性动物自灌胃第22d出现体重降低情况,至灌胃第28d低剂量组恢复正常,高剂量虽有差异但幅度减小(P值增大)。
(2)木薯茎叶试验组
雌性动物:各称重日组间体重均无差异。
雄性动物:灌胃第15d高剂量组(P=0.000)、低剂量组(P=0.000)与溶媒对照组相比均有显著差异,体重降低明显;灌胃第22d高剂量组与溶媒对照组相比有显著差异(P=0.023),体重降低。
小结:受试物木薯茎叶对雄性动物体重降低有影响,但随着灌胃时间延续,该影响逐步消除,至灌胃第28d各剂量组体重均数无差异;对雌性动物未观察到影响。
(3) 苎麻试验组
雌性动物:灌胃第15d高剂量组(P=0.012)、低剂量组(P=0.009)与溶媒对照组相比均有显著差异,体重降低。
雄性动物:灌胃第22d高剂量组与溶媒对照组相比均有显著差异(P=0.025),体重降低。
小结:受试物苎麻对动物体重降低影响仅出现在单一时间点(雌性:D15;雄性:D22),但随后各剂量组动物体重均恢复正常,灌胃第28d各剂量组体重与溶媒对照组均无显著差异。
(4)香蕉茎叶试验组
雌性动物:灌胃第22d高剂量组与低剂量组、溶媒对照组相比均有显著差异(P=0.000),体重明显降低。
雄性动物:灌胃第8d低剂量与溶媒对照组相比均有显著差异(P=0.001),体重降低;灌胃第22d低剂量与溶媒对照组相比有显著差异(P=0.01),体重降低。
小结:受试物香蕉茎叶对动物体重降低影响仅出现在单一时间点(雌性:D22;雄性:D8、D22),但随后各剂量组动物体重均恢复正常,灌胃第28d各剂量组体重与溶媒对照组均无显著差异。
(5)木薯渣试验组
各剂量组雌雄动物在各称重日体重与溶媒对照组相比均无差异。
3.摄食量
摄食量测量值为每笼动物(10只)一周饲料消耗量,各受试物每个剂量组动物每周摄食量只有1个数值,因而摄食量数据不做统计分析,仅做描述分析。
(1)桑叶试验组
雌性动物:第1、2周摄食量低于溶媒对照组,3、4周摄食量基本与溶媒对照组一致。
雄性动物:4周摄食量略低于溶媒对照组。
(2)木薯茎叶试验组
雌性动物:4周摄食量略低于溶媒对照组。
雄性动物:第1、2周摄食量低于溶媒对照组,3、4周摄食量基本与溶媒对照组一致。
(3) 苎麻试验组
雌性动物:4周摄食量略低于溶媒对照组。
雄性动物:高剂量组第1、2周摄食量低于溶媒对照组和低剂量组,3、4周摄食量略低于溶媒对照组;低剂量组4周摄食量略低于溶媒对照组。
(4)香蕉茎叶试验组
雌性动物:第1、2、4周摄食量基本与溶媒对照组一致;第3周低于溶媒对照组。
雄性动物:4周摄食量略低于溶媒对照组。
(5)木薯渣试验组
雌性动物:4周摄食量略低于溶媒对照组。
雄性动物:4周摄食量略低于溶媒对照组。
4.血液生化指标
(1)灌胃期结束血液生化指标变化情况
各受试物高、低剂量组与同期溶媒对照组动物按照雌、雄及总体(雌雄合并)分别进行统计分析,变化情况如下:
①桑叶试验组。雌、雄及总体动物各项血液生化指标与溶媒对照相比均无统计学差异(P>0.05)。
②木薯茎叶试验组。出现统计学差异指标:低剂量(总体)TG降低(P=0.02)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅低剂量(总体)TG降低,但该变化无剂量相关性,亦无毒理学意义。
③苎麻试验组。雌、雄及总体动物各项血液生化指标与溶媒对照相比均无显著差异(P>0.05)。
④香蕉茎叶试验组。出现统计学差异指标:低剂量(雄性)CK降低(P=0.033);低剂量(总体)CK降低(P=0.006)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅低剂量(雄性)和低剂量(总体)CK降低,但该变化无剂量相关性,亦无毒理学意义。
⑤木薯渣试验组。出现统计学差异指标:低剂量(雄性)TG升高(P=0.034)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅低剂量(雄性)TG升高,但该变化无剂量相关性且变化幅度较小,属于正常的试验波动。
(2)恢复期结束血液生化指标变化情况
各受试物高、低剂量组与同期溶媒对照组动物按照总体(雌雄合并)进行统计分析,变化情况如下:
①桑叶试验组。出现统计学差异指标:高剂量组BUN降低(P=0.026);低剂量组BUN升高(P=0.002)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅BUN出现变化,但该变化趋势无剂量相关性且变化幅度较小,属于正常的试验波动。
②木薯茎叶试验组。出现统计学差异指标:高剂量组BUN升高(P=0.006),TC降低(P=0.006)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,高剂量组BUN升高,对比其同期相关脏器病理学检查,未发现病变情况,可判定但该变化无毒理学意义;高剂量组TC降低,该变化无毒理学意义。
③苎麻试验组。各剂量组指标与溶媒对照相比均无显著差异(P>0.05)。
④香蕉茎叶试验组。各剂量组指标与溶媒对照相比均无显著差异(P>0.05)。
⑤木薯渣试验组。出现统计学差异指标:低剂量组BUN升高(P=0.023);高剂量组TC降低(P=0.022)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,低剂量BUN升高,该变化无剂量相关性且变化幅度较小,可判定无毒理学意义;高剂量组TC降低,该变化无毒理学意义。
5.血液学及凝血指标
(1)灌胃期结束血液学及凝血指标变化情况
各受试物高、低剂量组与同期溶媒对照组动物按照雌、雄及总体(雌雄合并)分别进行统计分析,变化情况如下:
①桑叶试验组。出现统计学差异指标:高剂量组(雄性)MCV降低(P=0.019),低剂量组(雄性)MCV降低(P=0.009);低剂量(雄性)MCH降低(P=0.01);高剂量组(雌性)TT升高(p=0.033),高剂量组(总体)TT升高(P=0.012)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅雄性动物高、低剂量MCV降低,低剂量MCH降低,以上变化其绝对变化值均较小,属正常试验波动可判定无毒理学意义;高剂量组雌性及总体动物TT升高,但其余凝血指标无变化,可判定该变化无明确毒理学意义。
②木薯茎叶试验组。雌、雄及总体动物各项血液学及凝血指标与溶媒对照相比均无显著差异(P>0.05)。
③苎麻试验组。出现统计学差异指标:低剂量组(雌性)Gran升高(P=0.039)、低剂量组(雌性)Gran%升高(P=0.031);高剂量组(雄性)Gran%升高(P=0.043);高剂量(雌性)MCH降低(P=0.043),高剂量(总体)MCH降低(P=0.012);高剂量(总体)MCHC降低(P=0.026);高剂量组(雌性)TT升高(P=0.012)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,单一性别或剂量组动物出现Gran、Gran%、TT变化,高剂量组MCH、MCHC降低,以上变化的绝对变化值较小,属正常试验波动可判定无毒理学意义。
④香蕉茎叶试验组。出现统计学差异指标:高剂量(雄)APTT降低(P=0.034),高剂量(总体)APTT降低(P=0.026)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅高剂量组动物APTT降低,该变化的绝对变化值较小,属正常试验波动可判定无毒理学意义。
⑤木薯渣试验组。出现统计学差异指标:高剂量(雄性)Lymph降低(P=0.016),Gran%升高(P=0.022),MPV升高(P=0.043)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅高剂量组(雄性)Lymph、Gran%、MPV出现变化,上述变化的绝对变化值较小,属于正常的试验波动,且高剂量组总体(雌性合并)以上变化指标均未出现统计学差异,可判定以上变化无毒理学意义。
(2)恢复期结束血液学及凝血指标变化情况
各受试物高、低剂量组与同期溶媒对照组动物按照总体(雌雄合并)进行统计分析,变化情况如下:
①桑叶试验组。出现统计学差异指标:低剂量组RBC升高(P=0.047);低剂量组HGB升高(P=0.04);低剂量组RDW降低(P=0.032)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅低剂量组RBC、HGB升高,RDW降低,上述变化无剂量相关性且变化幅度较小,可判定无毒理学意义。
②木薯茎叶试验组。出现统计学差异指标:高剂量组MCHC升高(P=0.042)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比,仅高剂量组MCHC升高,该变化幅度较小属正常试验波动,可判定但该变化无毒理学意义。
③苎麻试验组。出现统计学差异指标:高剂量组PLT降低(P=0.008),PDW升高(P=0.033)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比:高剂量组PLT降低,该变化无同期其它检测指标(凝血4项指标未出现统计学差异和变化)变化趋势联系和佐证,可判定无毒理学意义;PDW升高,该变化幅度较小属正常试验波动,可判定该变化无毒理学意义。
④香蕉茎叶试验组。各剂量组指标与溶媒对照相比均无显著差异(P>0.05)。
⑤木薯渣试验组。出现统计学差异指标:高剂量组PLT升高(P=0.016)。
其余各指标无显著差异(P>0.05);各剂量组与溶媒对照组相比:高剂量PLT升高,该变化无同期其它检测指标(凝血4项指标未出现统计学差异和变化)变化趋势联系和佐证,可判定无毒理学意义。
6.脏器系数
各受试物高、低剂量组与同期溶媒对照组动物按照雌、雄分别进行统计分析,变化情况如下:
(1)灌胃期结束脏器系数变化情况
①桑叶试验组。雌、雄性动物测量各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
②木薯茎叶试验组。雌、雄性动物测量各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
③苎麻试验组。雌性动物:各器官脏器系数与溶媒对照相比均无显著差异(P>0.05);雄性动物:低剂量组肝脏系数降低(P=0.009),该组动物肝脏的绝对重量无差异,且肝脏组织病理学与肝功能各项指标亦未见异常,故上述改变无明显毒理学意义;其余各器官脏器系数无显著差异(P>0.05)。
④香蕉茎叶试验组。雌性动物:高剂量组肺系数升高(P=0.035),该变化幅度较小,且肺组织病理学检查未见异常,可判定该变化无毒理学意义。雄性动物:各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
⑤木薯渣试验组。雌、雄性动物测量各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
(2) 恢复期结束脏器系数变化情况
①桑叶试验组。雌性动物:低剂量组肺系数降低(P=0.014);低剂量组脾脏降低(P=0.019)雄性动物:各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
②木薯茎叶试验组。雌、雄性动物测量各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
③苎麻试验组。雌、雄性动物测量各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
④香蕉茎叶试验组。雌、雄性动物测量各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
⑤木薯渣试验组。雌、雄性动物测量各器官脏器系数与溶媒对照相比均无显著差异(P>0.05)。
7.大体解剖观察及组织病理学检查
(1)大体解剖观察
灌胃期及恢复期结束,大体解剖观察5种受试物试验组大鼠脑、心脏、肝脏、脾脏、肺、肾脏、胃肠道、生殖系统等各组织或脏器大小、形态、颜色、质地均未见与受试物相关的异常改变。
(2)组织病理学检查
灌胃及恢复期结束,5种受试物试验组大鼠心脏、肝脏、脾脏、肺、肾脏、胃肠道等组织或脏器均未见与受试物相关的病理组织学改变。
(七)结 论
综上所述,在本试验条件下,SD大鼠连续28d经口灌胃分别给予5种受试物,各受试物高、低两个剂量组大鼠一般状态、体重、摄食量、血液学及凝血、血液生化、脏器系数、组织病理学等检查均未见与受试物相关的异常改变。
本试验条件下,5种受试物连续28d经口灌胃分别给予SD大鼠,其各自无毒性反应剂量(NOAEL)为:
①桑叶:2.00g/kg。
②木薯茎叶:1.00g/kg。
③苎麻:2.00g/kg。
④香蕉茎叶:4.00g/kg。
⑤木薯渣:6.67g/kg。
