《中华人民共和国药典》
《中华人民共和国药典》(简称《中国药典》)是我国用于药品生产和管理的法典,由国家食品药品监督管理局药典委员会编纂,经国务院批准后,国家食品药品监督管理局颁布执行。它是国家监督管理药品质量法法定技术标准。
《中国药典》收载的品种为疗效确切、被广泛应用、能批量生产、质量水平较高、并有合理的质量控制手段的药品。新中国成立以来,《中国药典》已出版了十部,分别为1953、1963、1977、1985、1990、1995、2000、2005、2010和2015年版。其中1953年版与1963年版各为一册,1977年版至2000年版分为一部、二部共两册。一部收载中药材、中成药;二部收载化学药品、抗生素、生化药品、生物制品及放射性药品。2010年版分为一部、二部和三部共三册,各自成书。其中,一部收载中药材及饮片、植物油脂和提取物、成方制剂和单味制剂等;二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料等;三部收载生物制品。
《中国药典(2015年版)》由一部、二部、三部、四部及其增补版构成。一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等;二部收载化学药品、抗生素、生化药品及放射性药品等;三部收载生物制品;为解决长期以来各部药典检测方法重复收录,方法间不协调、不统一、不规范的问题,本版对各部共性附录进行整合,将原附录更名为通则,包括制剂通则、检定方法、标准物质、试剂试药和指导原则。重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。《中国药典(2015年版)》2015年6月5日出版,2015年12月1日实施。
《中国药典》包括凡例、正文、通则和索引四个部分,其配套资料有《中药彩色图集》《中药薄层色谱彩色图集》《临床用药须知》《中国药品通用名称》及《药品红外光谱集》等。
1.凡例 凡例是解释和使用《中国药典》、正确进行质量检定的基本原则,它将与正文、通则及质量检定有关的共性问题统一规定,有关规定具有法定的约束力。
为了正确地理解与使用《中国药典》,应逐条阅读并弄懂其内涵。特别是与药物分析工作密切相关的条文,更应仔细阅读、准确理解、熟练掌握、正确执行。鉴于有关内容较多,在此仅举数项说明,详细内容参见《中国药典》。
(1)项目与要求:如药品的溶解度的表示:极易溶解系指溶质1 g(mL)能在溶剂不到1 mL中溶解;易溶系指溶质1 g(mL)能在溶剂1 mL至不到10 mL中溶解;阴凉处系指不超过20℃。
(2)计量:如凡例规定,密度单位为kg/m3、g/cm3;“水浴温度”指98~100℃,“室温”指10~30℃,“冷水”指2~10℃。
(3)精确度:如“精密称定”指称取质量应准确至所取量的1‰;“精密量取”指量取的体积的准确度应符合国家标准中对该体积移液管的精密度要求。“恒重”,除另有规定外,指供试品经连续两次干燥或炽灼后的质量差异在0.3 mg以下的质量。“按干燥品(或无水物,或无溶剂)计算”,除另有规定外,指取未经干燥(或未去水,或未去溶剂)的供试品进行试验,测得干燥失重(或水分,或溶剂),再在计算时从取用量中扣除。“空白试验”指试验中不加供试品,或以等量的溶剂替代供试品溶液,或试验中不加有关试剂,按供试品溶液同样方法、步骤操作。
2.正文 正文是《中国药典》的主要内容,收载了不同药品、制剂的质量标准。《中国药典》各部收载的正文内容略有差异。以二部为例,正文对每一品种按中文药品名称笔画顺序排列,单方制剂排在原料药后面。其内容根据品种和剂型的不同,按顺序可分别列有:品名(包括中文名、汉语拼音名与英文名),有机物的结构式,分子式、相对分子质量与CAS编号,来源,制法,性状,鉴别,理化检查,含量测定,类别,贮藏,标示等。
药物制剂的质量标准编排在相应药物质量标准之后,所含项目与原料药质量标准相近,但不列出有效成分的分子式和相对分子质量,同时在检查项下增加制剂的检查项目。
《中国药典》收载的“阿司匹林”正文内容如下:
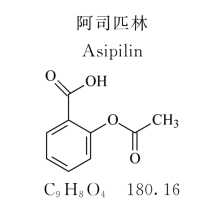
本品为2-(乙酰氧基)苯甲酸。含C9H8O4不得少于99.5%。
【性状】 本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
【鉴别】
(1)取本品约0.1 g,加水10 mL,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0.5 g,加碳酸钠试液10 mL,煮沸2 min后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集5图)一致。
【检查】
(1)溶液的澄清度:取本品0.50 g,加温热至约45℃的碳酸钠试液10 mL溶解后,溶液应澄清。
(2)游离水杨酸:临用新制。取本品约0.10 g,精密称定,置10 mL容量瓶中,加1%冰醋酸的甲醇溶液适量,振摇使溶解,并稀释至刻度,摇匀,作为供试品溶液;取水杨酸对照品约10 mg,精密称定,置100 mL容量瓶中,加1%冰醋酸的甲醇溶液适量使溶解并稀释至刻度,摇匀,精密量取5 mL,置50 mL容量瓶中,用1%冰醋酸的甲醇溶液稀释至刻度,摇匀,作为对照品溶液。照高效液相色谱法(通则0512)试验。用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20∶5∶5∶70)为流动相;检测波长为303 nm。理论板数按水杨酸峰计算不低于5 000,阿司匹林峰与水杨酸峰的分离度应符合要求,立即精密量取对照品溶液与供试品溶液各10 L分别注入液相色谱仪,记录色谱图。供试品溶液色谱图中如有与水杨酸峰保留时间一致的色谱峰,按外标法以峰面积计算,不得过0.1%。
L分别注入液相色谱仪,记录色谱图。供试品溶液色谱图中如有与水杨酸峰保留时间一致的色谱峰,按外标法以峰面积计算,不得过0.1%。
(3)易炭化物:取本品0.5 g,依法检查(通则0842),与对照液(取比色用氯化钴液0.25 mL、比色用重铬酸钾液0.25 mL、比色用硫酸铜液0.40 mL,加水至5 mL)比较,不得更深。(https://www.daowen.com)
(4)有关物质:取本品约0.1 g,置10 mL容量瓶中,加1%冰醋酸的甲醇溶液适量,振摇使溶解并稀释至刻度,摇匀,作为供试品溶液;精密量取1 mL,置200 mL容量瓶中,用1%冰醋酸的甲醇溶液稀释至刻度,摇匀,作为对照品溶液;精密量取对照品溶液1 mL,置10 mL容量瓶中,用1%冰醋酸的甲醇溶液稀释至刻度,摇匀,作为灵敏度溶液。照高效液相色谱法(通则0512)试验。十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20∶5∶5∶70)为流动相A,乙腈为流动相B,按下表进梯度洗脱;检测波长为276 nm。阿司匹林峰的保留时间约8 min,阿司匹林峰与水杨酸峰的分离度应符合要求。分别精密量取供试品溶液、对照品溶液、灵敏度溶液与游离水杨酸检查项下的水杨酸对照品溶液各10 L,注入液相色谱仪,记录谱图。供试品溶液色谱图中如有杂质峰,除水杨酸峰外,其各杂质峰面积的和不得大于对照溶液主峰面积(0.5%)。试品溶液色谱图中小于灵敏度溶液主峰面积的色谱峰忽略不计。
L,注入液相色谱仪,记录谱图。供试品溶液色谱图中如有杂质峰,除水杨酸峰外,其各杂质峰面积的和不得大于对照溶液主峰面积(0.5%)。试品溶液色谱图中小于灵敏度溶液主峰面积的色谱峰忽略不计。

(5)干燥失重:取本品,置五氧化二磷为干燥剂的干燥器中,在60℃减压干燥至恒重,减失质量不得过0.5%(通则0831)。
(6)炽灼残渣:不得过0.1%(通则0841)。
(7)重金属:取本品1.0 g,加乙醇23 mL溶解后,加醋酸盐缓冲液(pH=3.5)2 mL,依法检查(通则0821第一法),含重金属不得过百万分之十。
【含量测定】 取本品约0.4 g,精密称定,加中性乙醇(对酚酞指示液显中性)20 mL溶解后,加酚酞指示液3滴,用氢氧化钠滴定液(0.1 mol/L)滴定。每1 mL氢氧化钠滴定液(0.1mol/L)相当于18.02 mg的C9H8O4。
【类别】 解热镇痛非甾体抗炎药,抗血小板聚集药。
【贮藏】 密封,在干燥处保存。
【制剂】 ①阿司匹林片。②阿司匹林肠溶片。③阿司匹林肠溶胶囊。④阿司匹林泡腾片。⑤阿司匹林栓。
质量标准的主要内容:
(1)名称:《中国药典》收载的药品名称包括中文名称、英文名、化学名。中文药品名称“阿司匹林”为药品的法定名称,系按照《中国药品通用名称》推荐的名称及其命名原则命名的,《中国药典》收载的中文药品名称均为法定名称。英文名“Aspirin”采用世界卫生组织编订的国际非专利药名(International Nonproprietary Names for Pharmaceutical Substance,INN)。有机药物化学名称应根据中国化学会编撰的《有机化学命名原则》命名,母体的选定与国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的命名系统一致。
(2)性状:性状是药品质量的重要表征之一。性状项下记述了药品的形态、臭、味、溶解度及物理常数等。
1)外观与臭味:指药物的形态、晶型、色泽及臭味等性质。
2)溶解度:《中国药典》采用“极易溶解、易溶、溶解、略溶、微溶、极微溶解、几乎不溶或不溶”来描述药品在不同的溶剂中的溶解性能。
3)物理常数:《中国药典》收载的物理常数包括相对密度、馏程、熔点、凝点、比旋度、折光度、黏度、酸度、皂化度、羟值、碘值、吸收系数等。它们是鉴定药品质量的重要指标。
(3)鉴别:鉴别项下的试验方法适用于药品的真伪鉴别,通常包含2~4个理化鉴别方法。详细内容在第三章讲述。
(4)检查:检查项下包括有效性、均一性、纯度要求与安全性四个方面,在教材中归纳为一般杂质检查、特殊杂质检查、制剂通则检查三部分。详细内容在第四章讲述。
(5)含量或效价测定:项下规定的试验方法用于测定原料及制剂中有效成分的含量。含量测定方法有化学分析、仪器分析。效价测定主要采用生物测定法。详细内容在第四章讲述。
(6)贮藏:药品的贮藏条件是药品能否有效用于临床的重要因素之一。药品是否需要低温贮藏,温度、湿度、光照等贮藏条件对药物存在形式有无影响等,通常通过药品稳定性试验来确定。
3.通则 通则主要包括制剂通则、通用检测方法和指导原则等内容。除《中国药典》三部自成体系,《中国药典》一、二、四部共同引用的通则统一收载于《中国药典》四部。
(1)制剂通则:按照药物剂型分类,收载有片剂、注射剂、颗粒剂等化学药品和中药制剂共41种剂型。在每种剂型下规定有该剂型的定义、基本要求和常规检查项目。如“0102注射剂”,规定了注射剂的定义、分类、常规检查项目“装量”“装量差异”“渗透压摩尔浓度”“可见异物”“不溶性微粒”“中药注射剂有关物质”“重金属及有害元素残留量”“无菌”“细菌内毒素或热原”等项目的检查方法及限度要求。
(2)通用检测方法:系各正文品种进行相同检测项目时所应采用的设备、程序、方法及限度。包括光谱法、色谱法、物理常数测定法、限量检查法、特性检查法、生物学相关检查法、中药相关检查法等20类243条。
(3)指导原则:系为执行《中国药典》、考察药品质量、起草与复核药品标准等所制定的指导性规定,不做强制的法定标准。收载有9001原料药物与制剂稳定性试验指导原则、9011药物制剂人体生物利用度和生物等效性试验指导原则、9102生物样品定量分析方法验证指导原则、9101药品质量标准分析方法验证指导原则等7类30条。
4.索引 《中国药典》除了正文前的按汉语拼音顺序排列的“中文品名目次”外,书末分别列有按汉语拼音顺序排列的中文索引和按英文字母顺序排列的英文索引,这些索引可供方便、快速地查询有关内容。
