片剂常规检查项目
片剂系指药物与适宜的辅料混匀压制而成的圆片状或异形片状的固体制剂。《中国药典》收载的片剂类型以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片、肠溶片与口崩片等。
《中国药典》“制剂通则”项下规定的片剂常规检查项目有:质量差异、崩解时限(含片、舌下片、口崩片等)、发泡量(阴道泡腾片)、分散均匀性(分散片)、融变时限(阴道片)、溶出度与释放度、含量均匀度、片剂脆碎度(非包衣片)微生物限度。
下面主要介绍《中国药典》“制剂通则”项下规定的片剂常规检查项目质量差异、含量均匀度检查、溶出度检查、释放度检查。
(一)质量差异
质量差异系指按规定称量方法称量片剂时,每片的质量与平均片重之间的差异。片剂生产过程中,由于颗粒的均匀度和流动性较差,生产设备性能较低等原因,可能使片剂的质量产生差异。质量差异检查,是通过控制各片间质量的一致性以保证药品剂量准确性的检查方法。

请扫码观看
1.方法 取供试品20片,精密称定总质量,求得平均片重后,再分别精密称定每片的质量,每片质量与平均片重相比较(凡无含量测定的片剂,每片质量应与标示片重比较),按表4-5中的规定,超出质量差异限度的不得多于2片,并不得有1片超出限度1倍或以上。
表4-5 片剂质量差异限度

2.具体操作 取空称量瓶,精密称定质量;再取供试品20片,置此称_量_瓶中,精密称定。两次称量值之差即为20片供试品的总质量,除以20,得平均片重(![]() )。从已称定总质量的20片供试品中,依次用镊子取出1片,分别精密称定质量,得各片重量。
)。从已称定总质量的20片供试品中,依次用镊子取出1片,分别精密称定质量,得各片重量。
3.记录与计算
(1)记录每次称量数据。
(2)求出平均片重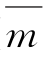 ),保留3位有效数字。修约至2__位有效数字,选择质量差异限度。按表4-5规定的质量差异限度,求出允许片重范围
),保留3位有效数字。修约至2__位有效数字,选择质量差异限度。按表4-5规定的质量差异限度,求出允许片重范围![]() ×质量差异限度)。
×质量差异限度)。
4.结果与判定
1)每片质量均未超出允许片重范围(![]() ×质量差异限度),或与平均片重相比较(凡无含量测定的片剂,每片质量应与标示片重相比较),均未超出表4-5中的质量差异限度;或超出质量差异限度的药片不多于2片,且均未超出限度1倍;均判为符合规定。
×质量差异限度),或与平均片重相比较(凡无含量测定的片剂,每片质量应与标示片重相比较),均未超出表4-5中的质量差异限度;或超出质量差异限度的药片不多于2片,且均未超出限度1倍;均判为符合规定。
5.注释
(1)《中国药典》规定,糖衣片的片芯应检查质量差异并符合规定,包糖衣后不再检查质量差异;薄膜衣片应在包薄膜衣后检查质量差异并符合规定;凡规定检查含量均匀度的片剂,一般不再进行质量差异检查。
(2)在称量前后,均应仔细查对药片数。称量过程中,应避免用手直接接触供试品。已取出的药片,不得再放回供试品原包装容器内。
(3)遇有检出超出质量差异限度的药片,宜另器保存,供必要时的复核用。
(4)结果判断时凡无含量测定的片剂,每片质量应与标示片重相比较。
(二)崩解时限
口服片剂在胃肠道中的崩解是药物溶解、被机体吸收、发挥药理作用的前提。如果片剂在一定时间内不能在体内崩解,便不能发挥其应有的作用。因此崩解时限是口服片剂的常规检查项目。
崩解系指口服固体制剂在规定时间内,于规定条件下全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。如有少量不能通过筛网,但已软化或轻质上漂且无硬心者,可作符合规定论。
崩解时限是指口服固体制剂在规定条件下,全部崩解溶散或出现规定现象所需的时间。崩解时限测定需采用专用的升降式崩解仪,主要结构为一能升降的金属支架与下端镶有筛网的吊篮,并附有挡板。

请扫码观看
1.方法 将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸入1 000 mL烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25 mm,烧杯内盛有温度为(37±1)℃的水,调节水位高度使吊篮上升时筛网在水面下15 mm处。除另有规定外,取供试品6片,分别置上述吊篮的玻璃管中,启动崩解仪进行检查,各片均应在15 min内全部崩解。如有1片不能完全崩解,应另取6片复试,均应符合规定。表4-6为《中国药典》收载的片剂崩解时限。
表4-6 片剂的崩解时限检查

(续表)

注:人工胃液取稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g,摇匀后,加水稀释成1 000 mL,即得。人工肠液即磷酸盐缓冲液(含胰酶)(pH=6.8)。
2.注释 《中国药典》规定:咀嚼片不进行崩解时限检查;凡规定检查溶出度、释放度或融变时限或分散均匀性的片剂,以及咀嚼片,不再进行崩解时限检查。本法适用于片剂、胶囊剂及滴丸剂的溶散时限检查。
(三)溶出度
溶出度系指药物从片剂、胶囊剂或颗粒剂等普通固体制剂在规定条件下溶出的速率和程度。测定法收载在《中国药典》四部特性检查法项下(通则0931)。
溶出度是反映药物在溶剂中溶解行为的一个最直观的数值,药物只有溶解了之后,才能被生物利用。药物在体内的吸收速度通常与溶出度成正比关系,故溶出度是评价固体药物质量的重要指标之一,同时也是生物利用度的体外观察方法。测定药物的溶出度,可以有效地控制药物的物料配比,以及反映生产过程中各因素的监控程度,可以在一定程度上反映人体使用药物之后的真实药效。目前片剂溶出度的测定主要用于难溶性药物,也可用于有效浓度与毒副反应浓度接近和制备工艺不太稳定,以及临床上疗效差异较大的口服固体制剂、控缓释制剂等。(https://www.daowen.com)
溶出度用下式表示:
![]()

请扫码观看
溶出度测定法是将某种制剂的一定量分别置于溶出度仪的转篮(或溶出杯)中,在37℃±0.5℃恒温下,在规定的转速、溶出介质中依法操作,在规定的时间内取样并测定其溶出量。《中国药典》附录收载了五种溶出度测定法。第一法为篮法,第二法为桨法,二者适用于普通制剂(片剂、胶囊剂)、缓释制剂或控释制剂、肠溶制剂;第三法为小杯法,适用于普通制剂(片剂、胶囊剂)、缓释制剂或控释制剂;第四法为桨碟法,第五法为转筒法,此二法适用于透皮贴剂。溶出度仪主要由电动机、恒温装置、篮体、篮轴、搅拌桨、溶出杯及杯盖、转筒等组成。现以普通制剂为例介绍第一法和第二法。
1.测定法 测定前,应对仪器装置进行必要的调试。第一法,安装转篮,使转篮底部距溶出杯的内底部25 mm±2 mm。第二法,安装搅拌桨,使桨叶底部距溶出杯的内底部25 mm±2 mm。第一法和第二法使用体积为1 000 mL的溶出杯。量取规定体积的经脱气处理的溶出介质,分别置于各溶出杯内,待溶出介质温度恒定在37℃±0.5℃后,取供试品6片(粒、袋),第一法分别投入6个干燥的转篮内,将转篮降入溶出杯;第二法投入溶出杯内(当品种正文项下规定需要使用沉降篮或其他沉降装置时,可将片剂或胶囊剂先装入规定的沉降篮内),按照品种项下规定的转速启动仪器,计时;至规定的取样时间,吸取溶出液适量,立即用不大于0.8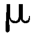 m的微孔滤膜滤过。取澄清滤液,照品种正文项下规定的方法测定,计算每片的溶出量。
m的微孔滤膜滤过。取澄清滤液,照品种正文项下规定的方法测定,计算每片的溶出量。
2.结果判定 符合下述条件之一者,可判为符合规定:
(1)6片(粒、袋)中,每片(粒、袋)的溶出量按标示量计算,均不低于规定限度Q。
(2)6片(粒、袋)中,如有1~2片(粒、袋)低于Q,但不低于Q-10%,且其平均溶出量不低于Q。
(3)6片(粒、袋)中,有1~2片(粒、袋)低于Q,其中仅有1片(粒、袋)低于Q-10%,但不低于Q-20%,且其平均溶出量不低于Q时,应另取6片(粒、袋)复试;初、复试的12片(粒、袋)中有1~3片(粒、袋)低于Q,其中仅有1片(粒、袋)低于Q-10%,但不低于Q-20%,且其平均溶出量不低于Q。
以上结果判断中所示的10%、20%是指相对于标示量的百分率(%)。
3.注释
(1)严格执行《中国药典》品种各论中规定的溶出液的取样位置、取样时间点,溶出介质种类、温度和体积。
(2)溶出介质除另有规定外,室温下体积为900 mL,并应新鲜配制和经脱气处理;如果溶出介质为缓冲液,当需要调节pH值时,一般调节至规定pH值在±0.05之内。
(3)由于溶解的气体在试验过程中可能形成气泡,从而影响试验结果,可采用该脱气方法:取溶出介质,在缓慢搅拌下加热至约41℃,并在真空条件下不断搅拌5 min以上;或采用煮沸、超声、抽滤等其他有效的除气方法。
(4)自6杯中完成取样的时间应在1 min内;实际取样时间与规定时间的差异不超过±2%;自取样至滤过应在30 s内完成。
(5)须多次取样时,所量取溶出液的体积之和应在溶出液的1%之内,如超出总体积的1%时,应及时补充相同体积的温度为37℃±0.5℃的溶出介质,或在计算时加以校正。
(6)除另有规定外,颗粒剂或干混悬剂的投样应在溶出介质表面分散投样,避免集中投样。
(7)如胶囊壳对分析有干扰,应取不少于6粒胶囊,除尽内容物后,置一个溶出杯内,按该品种项下规定的分析方法测定空胶囊的平均值,做必要的校正。如校正值大于标示量的25%,试验无效。如校正值不大于标示量的2%,可忽略不计。
(8)凡检查溶出度的制剂,不再进行崩解时限的检查。
(四)释放度
释放度系指药物从缓释制剂、控释制剂、肠溶制剂及透皮贴剂等在规定条件下释放的速率和程度。它是评价药物质量的一个指标,是模拟体内消化道条件,用规定的仪器,在规定的温度、介质、搅拌速率等条件下,对制剂进行药物释放速率试验,用以监测产品的生产工艺,以达到控制产品质量的目的。
释放度测定法收载在《中国药典》四部特性检查法项下(通则0931)。方法与溶出度检查一样,缓释制剂或控释制剂可用篮法、桨法、小杯法检查,肠溶制剂可用篮法、桨法检查,透皮贴剂可用桨碟法、转筒法检查。《中国药典》正文品种中有具体规定。释放度检查结果的判断,缓释制剂、控释制剂或透皮贴剂方法一致,肠溶制剂在《中国药典》四部通则有规定。
(五)含量均匀度
含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。在生产过程中,某些小剂量的剂型由于工艺或设备的原因,主药与片剂辅料难以混合均匀,质量差异不能准确反映片剂中主药的含量,可引起含量均匀度的差异。本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量准确。
1.测定法 除另有规定外,取供试品10片(个),照各品种项下规定的方法,分别测定每片(个)以标示量为100的相对含量Xi,求其平均值![]() 和标准差S[S=
和标准差S[S=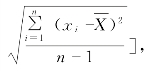 以及标示量与均值之差的绝对值A
以及标示量与均值之差的绝对值A![]()
2.结果判定 如A+2.2S≤L,则供试品的含量均匀度符合规定;若A+S>L,则不符合规定;若A+2.2S>L,且A+S≤L,则应另取20片(个)复试。根据初、复试结果,计算30片(个)的均值![]() 、标准差S和标示量与均值之差的绝对值A,再按下述公式计算并判定。
、标准差S和标示量与均值之差的绝对值A,再按下述公式计算并判定。
当A≤0.25L时,若A2+S2≤0.25L2,则供试品的含量均匀度符合规定;若A2+S2>0.25L2,则不符合规定。
当A>0.25L时,若A+1.7S≤L,则供试品的含量均匀度符合规定;若A+1.7S>L,则不符合规定。
式中,L为规定值。除另有规定外,L=15.0;单剂量包装的口服混悬液、内充非均相溶液的软胶囊、胶囊型或泡囊型粉雾剂、单剂量包装的眼用、耳用、鼻用混悬剂、固体或半固体制剂L=20.0;透皮贴剂、栓剂L=25.0。
3.注释
(1)当各品种正文项下__含量限度规定的上下限的平均值(T)大于100.0__(%)时,若![]() <100.0,则A=
<100.0,则A=![]() 若
若![]() 则A=0;若
则A=0;若![]() ,则
,则![]() 同上法计算,判定结果,即得。当T<100.0(%)时,应在各品种正文中规定A的计算方法。
同上法计算,判定结果,即得。当T<100.0(%)时,应在各品种正文中规定A的计算方法。
(2)当含量测定与含量均匀度检查所用检测方法不同时,而且含量均匀度未能从响应值求出每一个单剂含量情况下,可取供试品10个,照该品种含量均匀度_项下规定的方法,分别测定,得仪器测得的响应值Y(可为吸光度、峰面积等),求其均值![]() 。另由含量测定法测得以标示量为100的含量XA,由XA除以响应值的均值
。另由含量测定法测得以标示量为100的含量XA,由XA除以响应值的均值![]() ,得比例系数K(K=XA/
,得比例系数K(K=XA/![]() )。将上述诸响应值Yi与K相乘,求得每一个单剂以标示量为100的相对含量(%)Xi,(Xi=KYi),同上法求
)。将上述诸响应值Yi与K相乘,求得每一个单剂以标示量为100的相对含量(%)Xi,(Xi=KYi),同上法求![]() 和S以及A,计算,判定结果,即得。如需复试,应另取供试品20个,按上述方法测定,计算30个单剂的均值
和S以及A,计算,判定结果,即得。如需复试,应另取供试品20个,按上述方法测定,计算30个单剂的均值![]() 、比例系数K、相对含量(%)Xi、标准差S和A,判定结果,即得。
、比例系数K、相对含量(%)Xi、标准差S和A,判定结果,即得。
(3)用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时即使是同批号的溶剂,也应混合均匀后使用。
(4)供试品取样应随机抽取,不应采用其他方式筛选。供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解,并定量转移至容量瓶中。
(5)凡在药物正文中要求检查含量均匀度的制剂,一般不再检查质(装)量差异。
