一、化学分析法
(一)滴定分析法
1.方法原理及特点 滴定分析法(或称容量分析法),是将已知浓度的滴定液(标准物质溶液)由滴定管滴加到被测药物的溶液中,直至滴定液与被测药物反应完全(通过适当方法指示),然后根据滴定液的浓度和被消耗的体积,按化学计量关系计算出被测药物的含量。
滴定分析法操作简便、快速,仪器价廉易得,方法耐用性高,测定结果准确,相对误差一般在0.2%以下。但本法的专属性(选择性)较差,一般适用于含量较高的药物的定量分析。所以,滴定分析法首选于化学原料药的含量测定。
2.滴定分析法类型及适量对象 滴定分析法包括酸碱滴定法、非水滴定法、氧化还原滴定法、络合滴定法、沉淀滴定法等。其滴定方式有3种,即直接滴定法、间接滴定法和置换滴定法,其中直接滴定法和间接滴定法较常用。
酸碱滴定法一般在水溶液中进行,故本法适用于水(或与水混溶的有机溶剂)中溶解性较好、具较强酸或碱性药物,如阿司匹林、硼酸等;非水滴定法采用非水溶剂作介质,在药物分析中,以非水酸碱滴定法应用最为广泛,故本法适用于易溶于有机溶剂、具酸或碱性药物或其盐类,如各种生物碱类、胺类药物;络合滴定法适用于含金属离子药物,如葡萄糖酸钙等;氧化还原法按滴定液名称不同有不同的方法名称,如高锰酸钾法、重铬酸钾法、铈量法、碘量法、溴量法、溴酸钾法等,均适用于具还原性药物,如维生素C、肾上腺素等;亚硝酸钠法属氧化还原法中的一种,但其专属性强,仅适用于含芳伯氨基药物,如磺胺类药物;沉淀滴定法以银量法最常用,适用于能与银离子生成沉淀的药物,如氯化钠及其他盐酸盐等。
3.滴定分析法相关计算
(1)滴定度:指每1 mL规定浓度的滴定液所相当的被测药物的质量。质量单位在《中国药典》中以“毫克(mg)”表示。如以高氯酸滴定液直接滴定乳酸钠溶液时,其滴定度为“每1 mL的高氯酸滴定液(0.1 mol/L)相当于11.21 mg的C3H5Na O3”。
(2)滴定度的计算:容量分析中,被测药物分子(A)与滴定剂(B)之间按一定的摩尔比进行反应,反应可表示为
![]()
滴定度(T)可按下式计算:
式中,M为滴定液的摩尔浓度,b为被测药物的摩尔数,a为滴定液的摩尔数,B为被测药物的毫摩尔质量(相对分子质量)。
应用示例
溴酸钾法测定异烟肼含量时的滴定度计算:取本品约0.2 g,精密称定,置100 mL容量瓶中,加水使溶解并稀释至刻度,摇匀;精密量取25 mL,加水50 mL、盐酸20 mL与甲基橙指示液1滴,用溴酸钾滴定液(0.016 67 mol/L)缓缓滴定至粉红色消失。
解:溴酸钾法滴定异烟肼,其化学反应式如下:
![]()
异烟肼(C6H7N3O)相对分子质量=137.14,故据式(5-1)计算滴定度:
![]()
即每1 mL溴酸钾滴定液(0.016 67 mol/L)相当于3.429 mg的C6H7N3O。
(3)含量的计算:药物含量以百分含量或标示量百分含量表示,其基本计算公式如下:
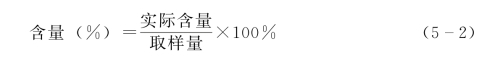

其中式(5-2)适用于原料药计算;式(5-3)适用于制剂计算。
1)直接滴定法:本法是以滴定液直接滴定供试品,据消耗滴定液体积数计算结果。根据滴定度定义可得,供试品溶液中药物量(M)有M=V×T,药物百分含量
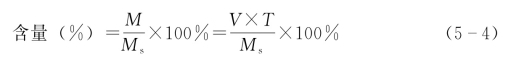
式中,V为滴定液被消耗的体积,mL;T为滴定度;Ms为供试品的称取量;称取量及滴定度单位应相同,即g或mg。
但实际工作中,所配制的滴定液的摩尔浓度(c实)与标准中规定的摩尔浓度(c标)不一定恰好符合,此时就不能直接应用标准中所给出的滴定度(T),而应是实际的滴定度(T′),两者关系为T′=T×F,式中
![]()
结合式(5-2)或式(5-3),可得原料药或制剂结果计算公式。
A.固体原料药百分含量计算公式如下:
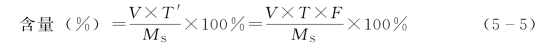
式中,F为滴定液的浓度校正因子;其他符号意义同式(5-4)。
应用示例(https://www.daowen.com)
苯甲酸的性状
阿司匹林含量测定:取本品约0.4 g,精密称定,加中性乙醇(对酚酞指示液显中性)20 mL溶解后,加酚酞指示液3滴,用氢氧化钠滴定液(0.1 mol/L)滴定。每1 mL氢氧化钠滴定液(0.1 mol/L)相当于18.02 mg的C9H8O4。
实验数据:M s=0.411 2 g VNaOH=21.60 mL cNaOH=0.104 2 mol/L
结果计算:

B.固体制剂(以片剂为例),其标示量百分含量计算公式如下:
![]()
式中各符号意义同式(5-4)。
应用示例
布洛芬片含量测定:取本品20片,除去包衣后,精密称定,研细,精密称取适量(约相当于布洛芬0.5 g),加中性乙醇(对酚酞指示液显中性)20 mL,振摇使布洛芬溶解,用垂熔玻璃漏斗滤过,容器与滤器用中性乙醇洗涤4次,每次10 mL,洗液与滤液合并,加酚酞指示液5滴,用氢氧化钠滴定液(0.1 mol/L)滴定。每1 mL氢氧化钠滴定液(0.1 mol/L)相当于20.63 mg的C13H18O2。
实验数据:标示量为100 mg/片;20片总重为2.000 0 g;取样量为0.580 0 g;消耗滴定液为24.82 mL,滴定液浓度为0.101 0 mol/L。
结果计算:

C.注射液,其标示量百分含量的计算公式如下:

式中,VS为取样量体积,mL;其他符号意义同式(5-4)。
应用示例
盐酸普鲁卡因注射液含量测定:精密量取本品5 mL,加水10 mL,照永停滴定法,用亚硝酸钠标准液(0.1 mol/L)滴定,每1 mL亚硝酸钠液(0.1 mol/L)相当于27.28 mg的C13H20N2O2·HCl。
实验数据:取样量5.00 mL;消耗滴定液体积为8.95 mL;硝酸钠滴定液浓度为0.101 2 mol/L;标示量为1 mL∶50 mg
结果计算:

2)剩余滴定法:亦称回滴法,此法是先加入定量过量的滴定液A,使其与被测药物反应,待此反应进行完全后,再用另一滴定液来回滴反应中剩余的滴定液A,一般情况下,同时以空白试验校正。式中,V0为空白试验消耗滴定液体积;Vb为样品测定试验消耗滴定液体积;T为滴定度;F为滴定液浓度校正因数;MS为供试品取样量,g。
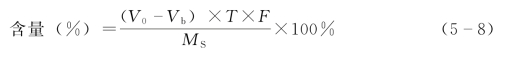
应用示例
氯贝丁酯的含量测定:取氯贝丁酯(C12H15Cl O3)原料药约2 g,精密称定,置锥形瓶中,加中性乙醇(对酚酞指示液显中性)10 mL与酚酞指示液数滴,滴加氢氧化钠滴定液(0.1 mol/L)至显粉红色,再精密加氢氧化钠滴定液(0.5 mol/L)20 mL,加热回流1 h至油珠完全消失,放冷,用新沸过的冷水洗涤冷凝管,洗液并入锥形瓶中,加酚酞指示液数滴,用盐酸滴定液(0.499 2 mol/L)滴定终点,并将滴定结果以空白试验校正。每1 mL盐酸滴定液(0.5 mol/L)相当于121.4 mg的C12H15ClO3。
实验数据:MS=2.056 1 g,Vb=16.45 mL,V0=23.26 mL,cHCl=0.499 2 mol/L。
结果计算:
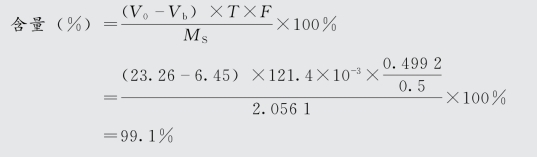
应用剩余滴定法测定制剂中药物含量,其结果计算公式类似直接测定法,只要将式中V换为(V0-Vb)即可,在此不再赘述。
(二)质量分析法
质量分析法是指用适当的方法将被测组分与试样中的其他组分分离,然后转化为一定的称量形式,以称质量计算该组分的含量的一种分析方法。其优点是准确度高、精密度好,但操作繁杂费时、样品用量较多,有时专属性较差,因而在药物分析中一般尽量避免采用。
目前,干燥失重、炽灼残渣、中草药灰分的测定、某些无其他简便准确含量测定方法可利用的药品等尚需应用质量法。
