颗粒剂常规检查项目
颗粒剂指原料药物与适宜的辅料混合制成具有一定粒度的干燥颗粒状制剂。颗粒剂可分为可溶性颗粒(通称为颗粒)、混悬颗粒、泡腾颗粒、肠溶颗粒、缓释颗粒和控释颗粒等。颗粒剂除按《中国药典》各药品项下规定的检验项目检查外,还应检查粒度、水分、干燥失重、溶化性、装量差异(单剂量包装的颗粒剂)、装量(多剂量包装的颗粒剂)、微生物限度等。
(一)粒度
为了控制颗粒剂中粒子的大小或限度,《中国药典》采用“粒度和粒度分布测定法”第二法即筛分法中的双筛分法检查颗粒剂的粒度,《中国药典》规定不能通过一号筛与能通过五号筛的总和不得超过15%。
1.操作方法 除另有规定外,取单剂量包装的5包(瓶)或多剂量包装的1包(瓶),称定质量,置该剂型或品种项下规定的上层小号筛中(下层大号筛下配有密合的接收容器),筛上加盖,保持水平状态过筛,左右往返,边筛动边拍打3 min。取不能通过一号筛和能通过五号筛的颗粒及粉末,称定质量,计算其所占比例(%)。
2.结果判断 颗粒剂(采用双筛分法)除另有规定外,不能通过一号筛(2 000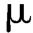 m)和能通过五号筛(180
m)和能通过五号筛(180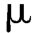 m)的颗粒和粉末的总和,如不超过供试量的15%,判为符合规定。超过供试量的15%,则判为不符合规定。
m)的颗粒和粉末的总和,如不超过供试量的15%,判为符合规定。超过供试量的15%,则判为不符合规定。
3.注释
(1)实验时需注意环境湿度,防止样品吸水或失水,除另有规定外,一般控制相对湿度在45%左右为佳。对易产生静电的样品,可加入不多于0.5%的胶质二氧化硅和(或)氧化铝等抗静电剂,以减小静电作用产生的影响。
(2)取样前,样品应混合均匀,这对粒度分析结果的准确性至关重要。
(3)手动筛分时,应注意过筛幅度、频率、时间和振动力度对结果的影响。
(4)理想的清洗药筛的方法是采用空气流或水流。如仍有颗粒残留在孔隙中,可使用刷子小心轻刷。(https://www.daowen.com)
(二)溶化性
除另有规定外,可溶颗粒剂和泡腾颗粒剂应检查溶化性。混悬颗粒及已规定检查溶出度或释放度的颗粒剂可不进行溶化性检查。
1.可溶颗粒检查法 取供试品10 g(中药单剂量包装取1袋),加热水200 mL,搅拌5 min,立即观察,可溶颗粒应全部溶化或轻微混浊,但不得有异物,中药颗粒还不得有焦屑。
2.泡腾颗粒检查法 取供试品3袋,将内容物分别转移至盛有200 mL水的烧杯中,水温为15~25℃,应迅速产生气体而成泡腾状,5 min内颗粒均应完全分散或溶解在水中。
(三)其他
1.干燥失重 除另有规定外,化学药品和生物制品颗粒剂还应照“干燥失重测定法”于105℃干燥(含糖颗粒剂应在80℃减压干燥)至恒重,减失质量不得超过2.0%。
2.水分 中药颗粒剂应照“水分测定法”检查水分,除另有规定外,水分不得过8.0%。
3.装量差异或装量 单剂量包装的颗粒剂应依法检查“装量差异”;多剂量包装的颗粒剂应照“最低装量检查法”检查“装量”。检查结果应符合《中国药典》规定。
4.微生物限度 以动物、植物、矿物质来源的非单体成分制成的颗粒剂,生物制品颗粒剂依法检查“微生物限度”,检查结果应符合规定。规定检查杂菌的生物制品颗粒剂,可不进行微生物限度检查。
