注射剂常规检查项目
注射剂系指原料药物与适宜的辅料制成的供注入体内的无菌制剂。《中国药典》中注射剂可分为注射液、注射用无菌粉末与注射用浓溶液。注射液系指原料药物或与适宜的辅料制成的供注入体的无菌液体制剂,包括溶液型、乳状液型或混悬型等注射液,可用于皮下注射、皮内注射、肌内注射、静脉注射、静脉滴注、鞘内注射、椎管内注射等。其中,供静脉滴注用的大容量注射液(除另有规定外,一般不小于100 mL,生物制品一般不小于50 mL)也可称为输液。注射用无菌粉末系指原料药物或与适宜辅料制成的供临用前用无菌溶液配制成注射液的无菌粉末或无菌块状物,一般采用无菌分装或冷冻干燥法制得。注射用浓溶液系指原料药物与适宜辅料制成的供临用前稀释后静脉滴注用的无菌浓溶液。
注射剂除应按《中国药典》各品种项下规定的检验项目检查外,还应检查装量(注射液及注射用浓溶液)、装量差异(注射用无菌粉末)、渗透压摩尔浓度、可见异物、不溶性微粒、中药注射剂有关物质、重金属及有害元素残留量、无菌、细菌内毒素或热原(静脉用注射液)。
(一)装量
注射液及注射用浓溶液应检查装量。本法适用于50 mL及50 mL以下的单剂量注射液的装量检査,其目的在于保证单剂量注射液的注射用量不少于标示量,以达到临床用药剂量要求。标示装量为50 mL以上的注射液和注射用浓溶液,按最低装量检查法检查,应符合规定。凡规定检查含量均匀度的注射液,可不进行“装量”检査。
1.测定法 标示装量不大于2 mL者,取供试品5支(瓶),2 mL以上至50 mL者取供试品3支(瓶);开启时注意避免损失,将内容物分别用相应体积的干燥注射器及注射针头抽尽,然后注入经标化的量入式量筒内(量筒的大小应使待测体积至少占其额定体积的40%),在室温下检视。测定油溶液或混悬液的装量时,应先加温(如有必要)摇匀,再用干燥注射器及注射针头抽尽后,同前法操作,放冷(加温时),检视,每支(瓶)的装量均不得少于其标示量。
2.注释
(1)测定时所用注射器应配上适宜号数的注射针头,其大小与临床使用情况相近为宜。
(2)生物制品多剂量供试品进行装量检查时应取供试品1支(瓶),按标示的剂量数和每剂的装量,分别用注射器抽出,按上述步骤测定单次剂量,应不低于标示量。
(3)最低装量检查法适用于固体、半固体和液体制剂的检查。分为质量法和滴定法。注射液和注射用浓溶液应采用滴定法检查。取50 mL以上的供试品3个,开启时注意避免损失,将内容物转移至预经标化的干燥量入式量筒中(量筒的大小应使待测体积至少占其额定体积的40%),黏稠液体倾出后,除另有规定外,将容器倒置15 min,尽量倾净。读出每个容器的装量,应均不少于标示装量的97%,且平均装量应不少于标示装量。如有1个容器装量不符合规定,则另取3个复试,应全部符合规定。
(4)也可采用质量除以相对密度计算装量。准确量取供试品,精密称定,求出每1 mL供试品的质量(供试品的相对密度);精密称定用干燥注射器及注射针头抽出或直接缓慢倾出供试品内容物的质量,再除以供试品相对密度,得出相应的装量。
(5)预装式注射器和弹筒式装置的供试品:标示装量不大于2 mL者,取供试品5支(瓶);2 mL以上至50 mL者,取供试品3支(瓶)。供试品与所配注射器、针头或活塞装配后将供试品缓慢连续注入容器(不排尽针头中的液体),按单剂量供试品要求进行装量检查,应不低于标示量。
(二)装量差异
注射用无菌粉末应检查装量差异,检查的目的在于控制各瓶间装量的一致性,以保证使用计量的准确。凡规定检查含量均匀度的注射用无菌粉末,可不进行“装量差异”的检查。
1.测定法 取供试品5瓶(支),除去标签、铝盖,容器外壁用乙醇擦净,干燥,开启时注意避免玻璃屑等异物落入容器中,分别迅速精密称定;容器为玻璃瓶的注射用无菌粉末,首先小心开启内塞,使容器内外气压平衡,盖紧后精密称定。然后倾出内容物,容器用水或乙醇洗净,在适宜条件下干燥后,再分别精密称定每一容器的质量,求出每瓶(支)的装量与平均装量。每瓶(支)装量与平均装量相比较(如有标示装量,则与标示装量相比较),即可判定其装量差异是否符合规定。
2.具体操作
(1)取供试品5瓶(支),除去瓶签(若为纸标签,用水润湿后除去纸屑;若为直接在玻璃瓶上印字标签,用适当有机溶剂擦除字迹),容器外壁用乙醇擦净,置干燥器内放置1~2 h,干燥后,除去铝盖,分别编号,依次放于固定位置。
(2)轻叩橡皮塞或安瓿颈,使其上附着的粉末全部落下,开启容器(注意避免玻璃屑等异物落入容器中),分别迅速精密称定每瓶(支)的质量,倾出内容物,容器用水、乙醇洗净,依次放回原固定位置,在适当的条件下干燥后,再分别精密称定每一容器的质量,即可求出每1瓶(支)的装量和平均装量。
(3)复试初试中,如有1瓶(支)的装量超过装量差异限度规定时,应另取10瓶(支)按上述方法复试。
3.记录与计算
(1)记录每次称量数据。
(2)根据每瓶(支)的质量与其空瓶重之差,求算每瓶(支)内容物质量。__
(3)每瓶(支)内容物质量之和除以5(复试时除以10),即得平均装量![]() 保留三位有效数字。
保留三位有效数字。
(4)按表4-7规定装量差异限度,求出允许装量范围![]()
表4-7 注射剂的装量差异限度

4.结果与判定
(1)每1瓶(支)中的装量均未超出允许装量范围![]() ,或其装量差异均未超过上表规定者,均判为符合规定。
,或其装量差异均未超过上表规定者,均判为符合规定。
(2)每1瓶(支)中的装量与平均装量相比较,超过装量差异限度的粉针多于1瓶者,判为不符合规定。
(3)初试结果如仅有1瓶(支)的装量差异超过装量差异限度时,应另取10瓶(支)复试。复试结果每1瓶(支)的装量差异与装量差异限度相比较,均未超过者,可判为符合规定;若仍有1瓶(支)或1瓶(支)以上超出时,则判为不符合规定。
5.注释
(1)开启安瓿装粉针时,应避免玻璃屑落入或溅失;开启橡皮塞铝盖玻璃瓶装粉针时,应先稍稍打开橡皮内塞使瓶内外的气压平衡,再盖紧后称重。
(2)用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦掉,以免影响称量结果;并将空容器与原橡皮塞或安瓿颈部配对放于原固定位置。(https://www.daowen.com)
(3)空容器的干燥,一般可于60~70℃加热1~2 h,也可在干燥器内干燥较长时间。
(4)称量空容器时,应注意瓶身与瓶塞(或折断的瓶颈部分)的配对。
(三)渗透压摩尔浓度
生物膜一般具有半透膜的性质,溶剂通过半透膜由低浓度溶液向高浓度溶液扩散的现象称为渗透,阻止渗透所需施加的压力,即为渗透压。渗透压对注射液、滴眼液、输液等剂型具有重要意义。
溶液的渗透压,通常以渗透压摩尔浓度(Osmolality)来表示,它反映的是溶液中各种溶质对溶液渗透压贡献的总和。渗透压摩尔浓度的单位,通常以每千克溶剂中溶质的毫渗透压摩尔(mOsmol/kg)来表示。
![]()
凡处方中添加了渗透压调节剂的制剂,均应控制其渗透压摩尔浓度。《中国药典》规定,除另有规定外,静脉输液及椎管注射用注射液按各品种项下规定,照渗透压摩尔浓度测定法检查,应符合规定。
渗透压摩尔浓度可由渗透压摩尔浓度测定仪进行测定。该仪器采用冰点下降的原理设计,通过测量溶液的冰点下降来间接测定其渗透压摩尔浓度。
1.测定法 按照仪器说明书操作,首先取适量新沸放冷的水调节仪器零点,然后选择两种标准溶液(供试液的渗透压摩尔浓度介于两者之间)校正仪器,再测定供试品溶液的渗透压摩尔浓度或冰点下降值。
2.注意事项
(1)渗透压摩尔浓度测定用的标准溶液由基准氯化钠配制,共有7种浓度。
(2)因0.9%的氯化钠溶液渗透压摩尔浓度与人体血液(285~310mOsmol/kg)相当,可用渗透压摩尔浓度比来衡量注射液与人体渗透压的关系。渗透压摩尔浓度比系指供试品溶液与0.9%(g/mL)氯化钠标准溶液的渗透压摩尔浓度比率。渗透压比等于1时为等渗溶液,大于1时为高渗溶液,小于1时为低渗溶液。计算公式为

式中,OT为供试品溶液的渗透压摩尔浓度;OS为0.9%(g/mL)氯化钠标准溶液的渗透压摩尔浓度。
(3)静脉输液、营养液、电解质或渗透利尿剂等应在说明书上表明其渗透压摩尔浓度,便于临床医生根据实际需要对所用制剂进行适当处理(如稀释)。
(四)可见异物
可见异物系指存在于注射剂、眼用液体制剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50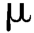 m。注射液中若有不溶性微粒,可能引起静脉炎、过敏反应甚至堵塞毛细血管。
m。注射液中若有不溶性微粒,可能引起静脉炎、过敏反应甚至堵塞毛细血管。
注射剂、眼用制剂应在符合GMP的条件下生产,产品在出厂前应逐一检查并剔除不合格产品,临用前在自然光下目视检查(避免阳光直射),如有可见异物,不得使用。
实验室检测时应避免引入可见异物。当制备注射用无菌粉末和无菌原料药供试品溶液时,或供试品溶液的容器不适于检测(如不透明、不规则形状容器等),需转移至适宜容器中时,均应在B级的洁净环境(如层流净化台)中进行。
《中国药典》收载的可见异物检查法有灯检法和光散射法。一般常用灯检法。灯检法不适用的品种,如深色透明容器包装或液体色泽较深(一般深于各标准比色液7号)的品种也可选用光散射法。混悬型、乳状液型注射液和滴眼液不能使用光散射法。本节只以注射液为例介绍灯检法。
1.检查装置、环境、人员 检查应在暗室中进行。光源采用带遮光板的日光灯,用无色透明容器包装的无色供试品溶液检查光照度应为1 000~1 500 lx;用透明塑料容器包装或用棕色透明容器包装的供试品溶液或有色供试品溶液检查光照度应为2 000~3 000 lx;乳状液或混悬液检查光照度应约为4 000 lx。不反光的黑色面作为检查无色或白色异物的背景;不反光的白色面作为检查有色异物的背景。检査人员远距离和近距离视力测验,均应为4.9或4.9以上(矫正后视力应为5.0或5.0以上),应无色盲。
2.检查法 取各药品项下规定的供试品,注射液除另有规定外应取供试品20支(瓶),除去容器标签,擦净容器外壁,必要时将药液转移至洁净透明的适宜容器内。置供试品于遮光板边缘处,在明视距离(指供试品至人眼的清晰观测距离,通常为25 cm),分别在黑色和白色背景下,手持供试品颈部轻轻旋转和翻转容器使药液中可能存在的可见异物悬浮(避免产生气泡),轻轻翻摇后即用目检视,重复3次,总时限为20 s。供试品装量每支(瓶)在10 mL及10 mL以下的,每次检查可手持2支(瓶)。
3.结果判定 各类注射剂在静置一定时间后轻轻旋转时均不得检出烟雾状微粒柱,且不得检出金属屑、玻璃屑、长度或最大粒径超过2 mm的纤维和块状物等明显可见异物。微细可见异物(如点状物、2 mm以下的短纤维和块状物等)如有检出,除另有规定外,应分别符合下列规定。①溶液型静脉用注射液、注射用浓溶液20支(瓶)供试品中,均不得检出明显可见异物。如检出微细可见异物的供试品仅有1支(瓶),应另取20支(瓶)同法复试,均不得检出。②溶液型非静脉注射液20支(瓶)供试品中,均不得检出明显可见异物。如检出微细可见异物,应另取20支(瓶)同法复试,初、复试供试品中检出微细可见异物的不得超过2支(瓶)。③混悬型、乳状液型注射液20支(瓶)供试品中,均不得检出金属屑、玻璃屑、色块、纤维等明显可见异物。
(五)不溶性微粒
不溶性微粒的检查系在可见异物检查符合规定后,进一步检查静脉用注射剂(溶液型注射液、注射用无菌粉末、注射用浓溶液)及供静脉注射用无菌原料药中不溶性微粒的大小和数量。《中国药典》通则“不溶性微粒检查法”有光阻法和显微计数法两种方法,当光阻法测定结果不符合规定或供试品不适于用光阻法测定时,应采用显微计数法进行测定,并以显微计数法的测定结果作为判断依据。
(六)中药注射剂有关物质
中药注射剂有关物质系指中药材经提取、纯化制成注射剂后,残留在注射剂中可能含有并需要控制的物质。除另有规定外,一般应检查蛋白质、鞣质、树脂等,静脉注射液还应检查草酸盐、钾离子等。
(七)重金属及有害元素残留量
除另有规定外,中药注射剂照铅、镉、砷、汞、铜测定法测定,按各品种项下每日最大使用量计算,铅不得超过12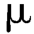 g,镉不得超过3
g,镉不得超过3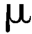 g,砷不得超过6
g,砷不得超过6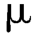 g,汞不得超过2
g,汞不得超过2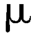 g,铜不得超过150
g,铜不得超过150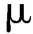 g。
g。
(八)其他
注射剂还应检查无菌,静脉用注射剂还应检查热原或细菌内毒素,检查方法见本章第四节,检查结果均应符合规定。
