原核生物的基因表达调控
原核生物结构简单,无细胞核结构,转录和翻译过程几乎同步进行,对环境条件的变化反应敏感,能迅速调整相应的基因表达,以适应变化的环境和维系自身的生长和繁殖。原核生物基因表达调控普遍采用具有较高“保险度”的负控制模式,在操纵子的框架结构中,通过阻遏蛋白或激活蛋白在转录水平上调节基因的表达。
1.转录水平的调控
(1)乳糖操纵子(lac)的调节作用与机制 E.coli的乳糖操纵子中的lacZ、lacY、lacA三个结构基因,分别编码β-半乳糖苷酶、β-半乳糖苷透性酶和半乳糖苷乙酰基转移酶。其中β-半乳糖苷酶可将乳糖水解成葡萄糖和半乳糖,供细菌利用;β-半乳糖苷透性酶可帮助乳糖进入细胞;半乳糖苷乙酰基转移酶能促使半乳糖发生乙酰化。当大肠杆菌在只含有乳糖的培养基中生长时,乳糖操纵子被诱导开启,由于Z、Y、A三个基因以多顺反子的形式顺序排列在操纵子中,三个基因一起被转录到同一条mRNA上,随后以大约5∶2∶1的比例协调翻译合成三种酶类。在乳糖的诱导下,一个菌体可合成多达几千个分子的β-半乳糖苷酶,完成对乳糖的分解代谢,获得能源,繁衍自己。当大肠杆菌在以葡萄糖或甘油作为碳源的培养基中生长时,阻遏蛋白结合在操纵基因上,阻止转录过程的启动,乳糖操纵子处于关闭状态。从原核生物对环境的适应角度出发,培养的环境中没有乳糖,大肠杆菌也没有必要合成分解乳糖的酶类,这也是选择的结果、进化的必然。
实际上,在大肠杆菌细胞内,真正生理性的并行使诱导效应的诱导物并非乳糖,而是乳糖的异构体——别位乳糖,它也是由乳糖经β-半乳糖苷酶(未经诱导时少量存在于细菌内)催化形成,并再经β-半乳糖苷酶水解为半乳糖和葡萄糖,如图2-13所示。
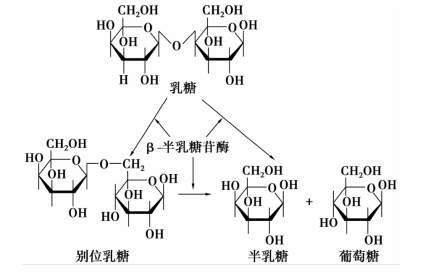
图2-13 β-半乳糖苷酶对乳糖的作用
①阻遏蛋白的调控。lac阻遏蛋白是由4个相同亚基组成的四聚体,每个亚基都有一个与诱导物——别位乳糖结合的位点。在没有诱导物的条件下,lac阻遏蛋白能与操纵基因O结合,从而阻止RNA聚合酶对结构基因的转录。当有诱导物存在时,诱导物与lac阻遏蛋白结合后,引起阻遏蛋白构象改变,对DNA的特异结合能力下降,导致阻遏物从操纵基因O上解离下来,RNA聚合酶不再受到阻碍,顺利转录结构基因Z、Y、A。在实验条件下常用异丙基硫代半乳糖(IPTG)作为诱导物代替别位乳糖,IPTG诱导作用很强,且由于它不是β-半乳糖苷酶的底物,因而不被代谢(图2-14)。
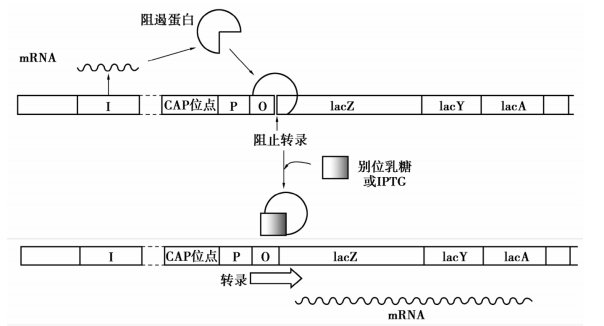
图2-14 阻遏蛋白对乳糖操纵子的调节
②CAP的正控制调控。大肠杆菌具有优先利用葡萄糖作为能源的特点。当大肠杆菌在含有葡萄糖的培养基中生长时,一些分解代谢酶,如β-半乳糖苷酶、半乳糖激酶、阿拉伯糖异构酶、色氨酸酶等的表达水平都很低,这种葡萄糖代谢过程对其他酶的抑制效应称为降解物阻遏作用。这种阻遏现象与cAMP有关。cAMP受体蛋白是一种同源二聚体,其分子内有DNA结合区和cAMP结合位点。CAP与cAMP结合形成复合物才能刺激操纵子结构基因的转录。当培养环境中葡萄糖浓度较低时,菌体内cAMP浓度会升高,CAP与cAMP结合形成cAMP-CAP复合物,并与启动子上游的CAP位点结合,刺激RNA聚合酶的转录作用,使转录效率提高50倍,显然,此时转录的前提条件是无阻遏效应存在,即在高浓度乳糖或别位乳糖条件下,负控制系统关闭。当葡萄糖浓度升高时,cAMP浓度降低,cAMP与CAP结合受阻,转录效率下降,如图2-15所示。由此可见,乳糖操纵子结构基因的高效表达必须满足两个条件,既需要有诱导物的存在(消除负控制的转录阻遏效应),又要求无葡萄糖或低浓度葡萄糖的条件(促进cAMP-CAP复合物的形成,产生正控制刺激转录效应)。乳糖操纵子调控模式在原核生物基因表达调控中具有普遍性。原核生物通过正控制和负控制机制的协调配合,来调节相关基因的表达,以适应环境条件的变化。
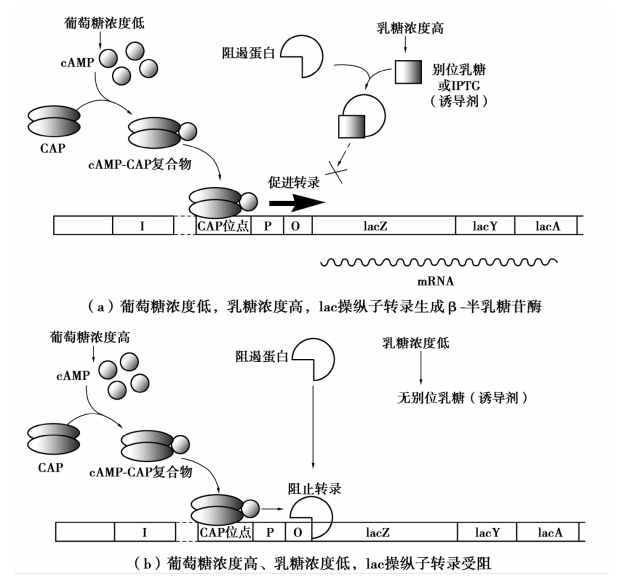
图2-15 CAP、阻遏蛋白、cAMP和诱导剂对乳糖操纵子的调节
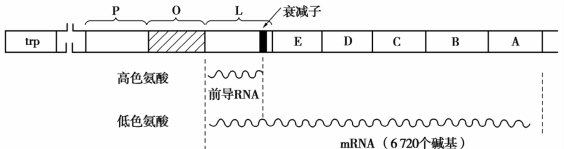
(2)色氨酸操纵子的转录衰减调控 原核生物的转录衰减是基因表达调控的重要方式。E.coli合成色氨酸所需的5种酶基因trpE、trpD、trpC、trpB、trpA顺序串联排列,构成一个负控制阻遏型操纵子,即trp操纵子。当色氨酸充足时,可与阻遏蛋白trp结合,引起阻遏蛋白trp的构象改变,进而增强阻遏蛋白与操纵基因O序列的结合能力,从而阻断基因转录;当培养环境中缺乏色氨酸时,菌体内没有色氨酸与阻遏蛋白trp结合,阻遏蛋白不能结合O序列,基因开始转录,合成6 720个核苷酸的完整的多顺反子mRNA。当菌体内仍有少量色氨酸,但又不足以形成色氨酸—阻遏蛋白复合物与操纵基因结合时,操纵基因处于开放状态,转录过程可以启动,但转录过程行进至前导序列L处便被终止,转录出一条140个核苷酸的转录产物,称为衰减转录物。这一精细、严谨的转录终止现象是通过140个核苷酸的RNA形成特殊的衰减子结构实现的,它使转录过程中断,避免色氨酸的合成过剩,如图2-16所示。
 (https://www.daowen.com)
(https://www.daowen.com)
图2-16 trp操纵子及其相应的转录产物
衰减子的作用机制是:在衰减子区域内有4段序列,邻近序列能相互配对形成二级结构,其中序列3和序列4配对,可形成类似基因末端的“不依赖Rho因子的转录终止子”结构,具有终止转录的作用;当序列2和序列3配对形成发夹结构时,序列3和序列4就无法配对,转录终止子结构不能形成,导致转录继续进行。在140个核苷酸的RNA链中编码有14个氨基酸的短肽,由于原核生物基因的转录和翻译过程同步进行,当色氨酸缺乏时,短肽翻译进行到序列1的色氨酸密码子处,因缺乏色氨酰-tRNA,核糖体在序列1处“停工待料”;序列2与序列3便可配对形成发夹结构;序列3和序列4之间的终止子结构不能形成,RNA聚合酶可以顺利完成全长多顺反子RNA的转录。而在菌体内只要有色氨酸存在,就会有色氨酰-tRNA的装载,短肽翻译过程中,核糖体能迅速通过序列1,并覆盖序列2,导致序列3与序列4配对形成终止子结构,转录终止。可见,转录衰减的调控机制实质上是在多顺反子mRNA5′端的前导序列中,通过是否翻译短肽来调控转录中断行为,如图2-17所示。

图2-17 trp操纵子的衰减作用示意图
(3)沙门菌基因重组调控 沙门菌为了逃避宿主的免疫监视,其鞭毛素蛋白的表达每经历1万次细胞分裂就发生一次变异。两种不同的鞭毛素(抗原)H1和H2分别由鞭毛素基因H1和H2编码。H2基因的启动子可以同时启动H2和一种阻遏蛋白的表达,这种阻遏蛋白可阻遏H1的表达。因此,在沙门菌中,当H2鞭毛素表达时,H1鞭毛素基因就不表达。H2基因的上游有一个编码倒位酶的基因hin,该酶可催化H2启动序列与hin基因倒位,其结果是使H2基因启动序列方向改变,而使H2及阻遏蛋白基因的表达被关闭,结果导致H1基因表达,如图2-18所示。
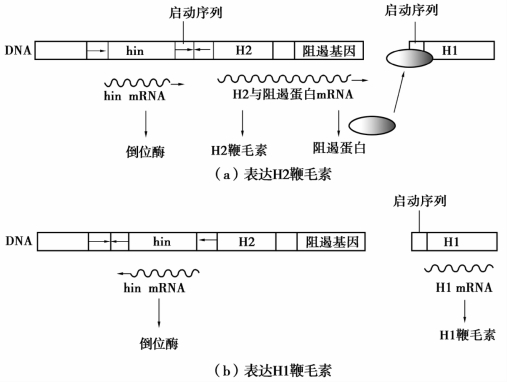
图2-18 沙门菌鞭毛素基因的调节
2.翻译水平的调控
翻译水平的调控是原核生物基因表达调控中除转录调控外的另一个重要层次,其调节作用包括:①SD序列对翻译的影响;②mRNA的稳定性;③翻译产物对翻译的影响。
(1)SD序列对翻译的影响 原核生物mRNA的5′端起始密码子AUG的上游3—10碱基处有一个核糖体结合位点,用发现者的名字将其命名为Shine-Dalgarno序列,简称SD序列。SD序列由3~9个碱基组成,富含嘌呤核苷酸,能与核糖体小亚基的16S rRNA 3′末端富含嘧啶的序列互补,而使核糖体与mRNA结合,因此,SD序列与翻译起始有关。
研究表明,SD序列与起始密码子之间的距离可以显著影响mRNA的翻译效率。在重组蛋白表达的研究中发现,lac启动子的SD顺序距AUG为7个核苷酸时,表达水平最高,而间隔8个核苷酸时,表达水平可降低数百倍。
(2)mRNA的稳定性 原核生物细胞mRNA通常是不稳定的,极易被降解。如E.coli的许多mRNA在30℃条件下的平均半衰期大约为2min。mRNA的快速降解使得许多蛋白质翻译的模板在几分钟内就被全部替换,这意味着诱导基因表达的因素一旦消失,蛋白质的合成就会迅速停止。由此可见,原核生物基因表达调控的主要环节在转录水平通过mRNA迅速合成、迅速降解来对环境变化做出快速反应进而做出快速应答。
(3)翻译产物对翻译的影响 有些mRNA编码的蛋白质,本身就是在蛋白质翻译过程中发挥作用的因子。这些因子可对自身的翻译产生调控作用。如原核生物中的起始因子3(IF-3),当它合成过多时,能有效地校正和抑制其自身的起始密码子与起始tRNA的配对,从而抑制翻译的起始。另外还有核糖体蛋白、翻译终止因子等均可影响翻译过程。
