限制性内切酶切割DNA的方法
1.单酶切割DNA样品
对DNA样品进行单一的限制性内切酶切割是基因工程分析的常用方法,通过切割可获得具有特定切点末端的小片段的DNA链。如果对两种不同来源的DNA分子分别用同一种酶进行切割,就可以将它们连接起来,组合成新的分子。若加入的两种分子分别是目标DNA和载体DNA,则通过这种方法可形成重组DNA,如图7-1所示。
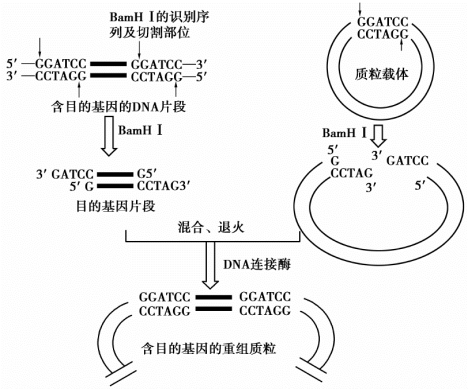
图7-1 单酶切割的DNA通过互补末端载体DNA的连接
酶切实验中需要将DNA样品和限制性内切酶混合于适合的缓冲液中进行温育,加入的DNA样品和酶的量、缓冲液的离子强度、酶切反应温育温度和时间都要根据具体的反应进行调节。酶切结束后,向酶切反应液中加入电泳上样缓冲液即可进行琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳进行检测。如图7-2所示。
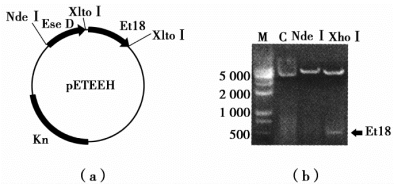
图7-2 质粒的图谱及其酶切检测结果
2.双酶或多酶切割DNA样品
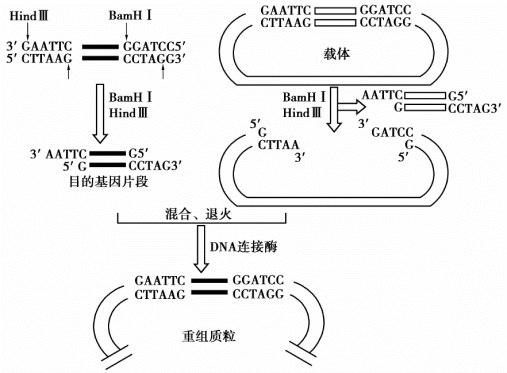
在基因工程研究中,常常需要两种或两种以上的限制性内切酶来切割DNA样品,以获得目的片段。如果用同样两种酶切割另一个DNA分子(如载体DNA),也可形成一个新的重组DNA分子。如图7-3所示。
 (https://www.daowen.com)
(https://www.daowen.com)
图7-3 双酶切割的DNA通过互补末端载体DNA的连接
如果这些酶的反应缓冲液和反应温度是相同的,则可以同时加入同一个反应体系中,进行同步酶切。很多商品化的限制性内切酶在几种缓冲液中都具有很高的内切酶活性,对缓冲液的要求并不十分严苛。那么在实际操作中,可选择一种可以使所用到的几种限制性内切酶同时具有活性的缓冲液来进行酶切反应。
但很多时候,我们用到的限制性内切酶的反应条件并不相同,这就需要进行分步酶切。如果酶的反应温度不一样,一般先进行低温度酶切,再进行高温度酶切,即只需要先加入较低温度的酶,在它所需要的温度下酶切1~2 h,再使用另一种酶,在它所需的较高温度下继续酶切。若限制性内切酶需要不同的盐浓度,那么就首先进行低盐浓度的限制性内切酶切割,随后调节盐浓度,再用高盐浓度的限制性内切酶切割。
如果几种酶的缓冲液体系差别较大,那么这种多酶切的分步酶切要更麻烦一些。这需要每次使用一种限制性内切酶对DNA样品进行酶切。在第一个酶的酶切反应进行1~2 h后,用等体积饱和酚/氯仿抽提,然后向转移到新管的水相加0.1倍体积3 mol/L NaAc和2倍体积无水乙醇,混匀后在-20℃冰箱放置30 min,离心、干燥并重新溶于缓冲液,以此DNA为模板,加入第二种酶及其缓冲液,进行第二个酶切反应。多次分步酶切时,要注意酶切时间不可过长,也不可多次冻融,避免DNA不稳定而降解。
在双酶切DNA样品时,如果两个酶切位点距离较近,就必须注意酶切顺序,因为一些限制性内切酶要求其识别序列的两端至少要有几个碱基才能保证此酶的有效切割。有这类要求的酶必须先进行切割,否则会导致酶切失败。
3.DNA样品的部分酶切
在进行酶切图谱分析或从基因组中进行某种基因的克隆时,往往只需要使用限制性内切酶对DNA样品上的限制性位点进行部分酶切。这种对DNA样品的部分酶切,可通过改变限制性内切酶的用量或改变酶切反应时间来实现。常用梯度稀释的方法来改变限制性内切酶的用量。酶切时间有30 s、1 min、5 min、10 min、20 min、30 min不等。经过对酶浓度的稀释和其作用时间的调整,来获得最佳的酶切效果。图7-4是采用Sau3AI对基因组DNA进行的部分酶切,可以看到,该酶在基因组上进行了不完全的酶切,将基因组DNA切割成连续的片段。
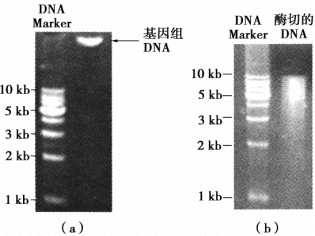
图7-4 DNA样品的部分酶切
